题目内容
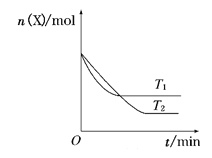
【题目】温度为T1时,向容积为2L的恒容密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。数据如下,下列说法错误的是( )
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡时,反应放出的热量为32.8kJB.T1时,反应的平衡常数K乙=1
C.平衡时,乙中CO的浓度是甲中的2倍D.乙容器中,平衡时H2O的转化率约为75%
【答案】D
【解析】
方程式左右两边气体计量系数之和相等,增大压强对该平衡无影响,甲乙物料投放比相同,故甲和乙是等效平衡,乙起始投放物料是甲的两倍,所以达到平衡,乙中各对应物质物质的量是甲的两倍。

A.热化学方程式表达的是消耗了1mol CO,反应放热41KJ,乙和甲是等效平衡,达到平衡CO消耗的物质的量是甲中的两倍,即消耗了0.8mol,反应放热0.8mol×41kJ·mol-1=32.8kJ,A不符合题目要求,A项错误;
B.同一温度下平衡常数不变,K乙= K甲,甲中各物质浓度分别为0.4mol/L、0.1mol/L、0.2mol/L、0.2mol/L,代入平衡常数表达式计算:K乙= K甲=![]() =1,B不符合题目要求, B项错误;
=1,B不符合题目要求, B项错误;
C.乙和甲是等效平衡,乙起始投放物料是甲的两倍,达到平衡,乙中各对应物质物质的量浓度是甲的两倍,C不符合题目要求,C项错误;
D.乙和甲的转化率相等,平衡时H2O的转化率:![]() =66.7%,D符合题意, D项正确;
=66.7%,D符合题意, D项正确;
答案选D。

【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。