题目内容
【题目】工业上利用硫黄生产硫酸的步骤及反应为:
①造气: ;
;
②催化氧化:![]() ;
;
③吸收:![]() 。
。
(1)根据图1写出![]() 与
与![]() 反应生成
反应生成![]() 的热化学方程式: ______ 。
的热化学方程式: ______ 。

(2)某温度下![]() ;
;![]() 。开始时在10L的密闭容器中加入
。开始时在10L的密闭容器中加入![]() 和
和![]() ,当反应达到平衡时共放出热量196kJ,求该温度下
,当反应达到平衡时共放出热量196kJ,求该温度下![]() 平衡常数K=______ 。
平衡常数K=______ 。
(3)某人设想以图2所示装置用电化学原理生产硫酸,写出通入![]() 的电极的电极反应式: ______ 。
的电极的电极反应式: ______ 。
(4)有两只密闭容器A和B,A容器有一移动的活塞能使容器内保持恒压,B容器能保持恒容,起始向这两只容器中分别充入等量的体积比为2:1的![]() 和
和![]() 的混合气体,并使A和B容积相等
的混合气体,并使A和B容积相等![]() 如图
如图![]() ,
,![]() 时发生如下反应:
时发生如下反应:![]() 填写下列空格:
填写下列空格:
①![]() 容器中
容器中![]() 的转化率比B容器 ______
的转化率比B容器 ______
②达到![]() 所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中
所述平衡后,若向两容器通入等量的原反应气体,达到平衡时A容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]() ,B容器中
,B容器中![]() 的体积分数 ______
的体积分数 ______ ![]() 增大、减小、不变
增大、减小、不变![]()
(5)对于反应![]() ,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______
,一定条件下达到平衡后,在保证O2浓度不变的情况下,增大容器的体积,试根据平衡常数,判断平衡 ______ ![]() 填“正向移动”、“逆向移动”或“不移动”
填“正向移动”、“逆向移动”或“不移动”![]()
【答案】![]()
![]() ;
; ![]() 大 不变 增大 不移动
大 不变 增大 不移动
【解析】
(1)分析图象能量变化,写出化学方程式,标注物质聚集状态和反应焓变写出热化学方程式;
(2)根据反应达到平衡过程中放出的热量计算出转化的![]() 的物质的量,确定平衡状态,再计算平衡常数;
的物质的量,确定平衡状态,再计算平衡常数;
(3)燃料电池中通氧气的极为正极,通![]() 的极为负极,发生氧化反应,据此书写电极反应式;
的极为负极,发生氧化反应,据此书写电极反应式;
(4)![]() 根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
![]() 根据浓度对化学平衡的影响,求出平衡移动后
根据浓度对化学平衡的影响,求出平衡移动后![]() 的体积分数;
的体积分数;
(5)根据浓度熵和平衡常数之间的关系来判断反应的状态。
(1)依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,S和O2生成SO3的热化学方程式为:![]() ,
,
故答案为:![]() ;
;
(2)当反应达到平衡时共放出热量196kJ,则变化的![]() 的物质的量为
的物质的量为![]() ,
,
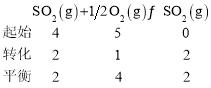
此时平衡常数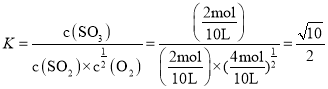 , 故答案为:
, 故答案为:![]() ;
;
(3)通SO的极是负极,发生氧化反应,其电极反应为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)![]() 若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中
若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中![]() 的转化率比B大, 故答案为:大;
的转化率比B大, 故答案为:大;
![]() 向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以
向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以![]() 的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中
的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中![]() 的体积分数增大, 故答案为:不变;增大;
的体积分数增大, 故答案为:不变;增大;
![]() 此时浓度商Qc仍然等于K,仍然是平衡状态,故选C;故答案为:不移动。
此时浓度商Qc仍然等于K,仍然是平衡状态,故选C;故答案为:不移动。

【题目】Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn(m≠n);
③M的基态原子2p能级有1个单电子;
④Q、X原子p轨道的未成对电子数都是2。
用化学术语回答下列问题:
(1)Z在周期表中的位置______________。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为__________ (用对应元素的符号填写)。
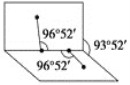
(3)X、M两元素形成的化合物XM2的VSEPR模型名称为_________,已知XM2分子的极性比水分子的极性弱,其原因是__________________。
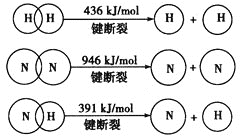
(4)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B | A≡B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
①结合数据说明QX比R2活泼的原因:________________________。
②QX与R2互为等电子体,QX的结构式为(若有配位键请用→表示)______。Fe易与QX形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,则此配合物化学式为_______。
【题目】碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。

(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:
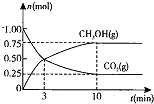
①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
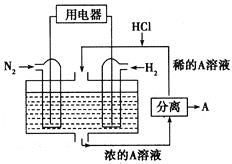
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
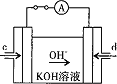
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。