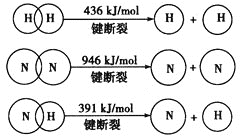
题目内容
【题目】25℃ 时,向体积均为20mL、浓度均为0.1000mol·L-1的三种酸HX、HY、HZ溶液中分别逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH与加入NaOH溶液的体积关系如图所示。下列说法正确的是( )
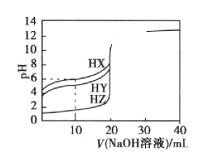
A.当V(NaOH溶液)=0mL时,三种溶液相比较c(X-)>c(Y-)>c(Z-)
B.当三种溶液pH均等于7时,反应消耗的n(HX)>n(HY)>n(HZ)
C.当V(NaOH溶液)=10mL时,反应后溶液中各离子浓度由大到小的顺序为c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY与HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
【答案】D
【解析】
A. 由图可知,![]() 的三种酸HX、HY、HZ溶液的
的三种酸HX、HY、HZ溶液的![]() ,故酸性强弱为
,故酸性强弱为![]() ,酸性越弱,电离程度越小,所以离子浓度
,酸性越弱,电离程度越小,所以离子浓度![]() ,故A错误;
,故A错误;
B. 酸溶液的体积、物质的量浓度均相同时,酸的酸性越弱,中和酸溶液至中性所消耗的碱的物质的量越少,所以反应消耗的酸的物质的量也越少,即![]() ,故B错误;
,故B错误;
C.当![]() 时,各溶液中的酸及其对应盐的物质的量浓度相等,酸的酸性越弱越不易电离,而其对应的盐越容易水解,溶液中酸根离子越少,
时,各溶液中的酸及其对应盐的物质的量浓度相等,酸的酸性越弱越不易电离,而其对应的盐越容易水解,溶液中酸根离子越少,![]() ,当
,当![]() 时混合溶液呈酸性,则
时混合溶液呈酸性,则![]() ,结合电荷守恒可知
,结合电荷守恒可知![]() ,所以当
,所以当![]() 时,
时,![]() ,故C错误;
,故C错误;
D. 根据电荷守恒,HY与HZ混合溶液中,![]() ,
,![]() ,所以
,所以![]() ,故D正确;
,故D正确;
故答案为D。

【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。

结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。
【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。