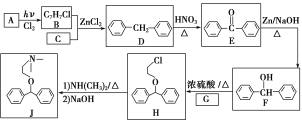
题目内容
【题目】![]() 实验室欲用NaOH固体配制
实验室欲用NaOH固体配制![]() 的NaOH溶液
的NaOH溶液![]() 。
。
①本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、250mL容量瓶、还有_________;
②要完成本实验该同学应称出____________![]() ;
;
③若直接在天平的两个托盘上放两张质量相等的纸片进行称量,则会使得配制结果_______。![]() 偏低、偏高或无影响
偏低、偏高或无影响![]()
![]() 铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
铁不能与冷、热水反应,但能与水蒸气反应。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当_________时![]() 填实验现象
填实验现象![]() ,说明“铁与水蒸气”能够进行反应;
,说明“铁与水蒸气”能够进行反应;
②写出该反应的化学方程式,并用单线桥表示出电子转移情况___________;
③为了研究一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积![]() 已折算成标准状况
已折算成标准状况![]() 。收集并测量气体体积应选下图中的________装置;
。收集并测量气体体积应选下图中的________装置;

若称取![]() 铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒
铁粉,然后与水蒸气加热至无气体放出,最好选用__________规格的量筒![]() 选填字母序号
选填字母序号![]() 。
。
A.100mL B.200mL C.500mL D.1000mL
【答案】胶头滴管 ![]() 偏低 肥皂泡爆破,并伴有爆鸣声
偏低 肥皂泡爆破,并伴有爆鸣声 
![]() B
B
【解析】
(1)①从配制一定物质的量浓度的溶液可知还要胶头滴管;
②因实验室没有240mL的容量瓶,故只能用250mL的,所以计算也要用这个来算,则有:![]() ;
;
③因氢氧化钠固体会吸水潮解,所以有纸片时在纸片上会有氢氧化钠,故溶液浓度会偏低;
(2)①当肥皂泡爆破,并伴有爆鸣声时说明已经有氢气产生,故说明铁与水能进行反应了;
②铁与水蒸气反应产生四氧化三铁与氢气,铁失电子,水中氢得电子,故有: ;
;
③A装置不能将水排出,故不能测量氢气的体积,故应当选B;据化学方程式可知![]() 铁粉产生的氢气为:
铁粉产生的氢气为:![]() ,所以用200mL的量筒,故B正确。
,所以用200mL的量筒,故B正确。

 习题精选系列答案
习题精选系列答案【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。