题目内容
【题目】化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧氧化管内样品,根据产物质量确定有机物的组成,装置如下图所示,是用燃烧法确定有机物化学式常用的装置。产生的氧气按从左到右流向各导管的连接顺序为g-f,e-h , i-c , d-a。
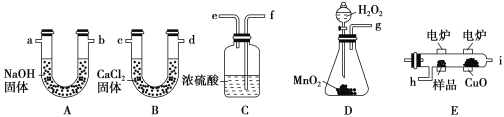
回答下列问题:
(1)C装置中浓H2SO4的作用______________________________________。
(2)D装置中MnO2的作用为________________________。
(3)E中CuO的作用为_____________________。
(4)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物最简式为______________,若此有机物的相对分子质量为90,则其分子式为______________。
【答案】吸收水分,干燥氧气 催化剂,加快产生氧气的速率 使有机物更充分氧化为CO2、H2O CH2O C3H6O3
【解析】
实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳、B用来吸收水、C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;确定物质的化学式可借助元素的质量守恒进行解答。
(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果;
(2)MnO2为分解制备氧气的催化剂,加快产生O2的速率;
(3)一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(4)A管质量增加1.32g说明生成了1.32g二氧化碳,可得碳元素的质量:1.32g×![]() ×100%=0.36g;B管质量增加0.54g说明生成了0.54g水,可得氢元素的质量:0.54g×
×100%=0.36g;B管质量增加0.54g说明生成了0.54g水,可得氢元素的质量:0.54g×![]() ×100%=0.06g;从而可推出含氧元素的质量为:0.9g-0.36g-0.06g=0.48g,设最简式为CXHYOZ,则X:Y:Z=
×100%=0.06g;从而可推出含氧元素的质量为:0.9g-0.36g-0.06g=0.48g,设最简式为CXHYOZ,则X:Y:Z=![]() :0.06:
:0.06:![]() ,X:Y:Z=1:2:1,即最简式为CH2O,设有机物的分子式为(CH2O)n,则n=
,X:Y:Z=1:2:1,即最简式为CH2O,设有机物的分子式为(CH2O)n,则n=![]() =3,即此有机物的分子式为C3H6O3。
=3,即此有机物的分子式为C3H6O3。

【题目】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________(填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为 _____________(填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________。