题目内容
3.下列关于氯气的叙述中不正确的是 ( )| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 将氢气和氯气混合光照,能安静地燃烧,产生苍白色火焰 | |
| D. | 与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
分析 A.氯气密度大于空气密度;
B.次氯酸为弱酸;
C.氢气与氯气光照条件下发生爆炸;
D.依据氯气与氢氧化钠反应中氯元素化合价变化判断.
解答 解:A.氯气密度大于空气密度,应选择向上排空气法收集,故A正确;
B.氯气与水反应生成次氯酸,次氯酸为弱电解质,故B正确;
C.氢气和氯气混合光照发生剧烈的爆炸,故C错误;
D.反应Cl2+2OH-=Cl-+ClO-+H2O中,氯的化合价既升高又降低,Cl2既被还原,同时又被氧化,故D正确;
故选:C.
点评 本题考查了元素化合物的性质,熟悉氯气的性质是解题关键,注意氯气与氢氧化钠反应时元素化合价变化,题目难度不大.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | 核素${\;}_{1}^{2}$H的中子数是0 | |
| B. | 12C和14C互为同位素 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | CH3CH2OH和CH3OCH3互为同分异构体 |
11.下列分子中,分子间不能形成氢键的是( )
| A. | NH3 | B. | HF | C. | C2H5OH | D. | CH4 |
8.在下述条件下,一定能大量共存的离子组是( )
| A. | 澄清透明的水溶液中:K+、Ba2+、OH-、MnO4- | |
| B. | pH=13的溶液中:Cl-,HCO3-,NO3-,NH4+ | |
| C. | c(Fe3+)=0.1mol•L-1的溶液中:Na+、SCN-、Cl-、Br- | |
| D. | 强碱性溶液中:ClO-、SO42-、SO32-、Na+ |
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
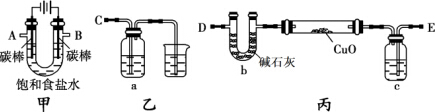 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.