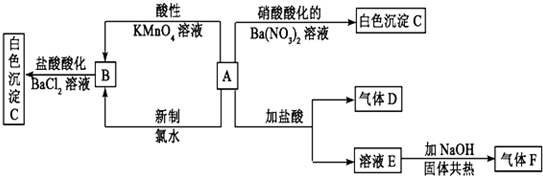
题目内容
11.下列分子中,分子间不能形成氢键的是( )| A. | NH3 | B. | HF | C. | C2H5OH | D. | CH4 |
分析 氢键结合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素.
解答 解:A.氨气分子间能形成氢键,表示为:N-H…N,故A不选,
B.氟化氢分子间能形成氢键,表示为:F-H…F,故B不选,
C.乙醇分子间能形成氢键,表示为:O-H…O,故C不选;
D.甲烷中碳原子的电负性不大,故分子间不能形成氢键,故D选;
故选D.
点评 本题考查氢键的形成条件,难度不大.要注意电负性大而原子半径较小的非金属原子与H原子结合才能形成氢键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.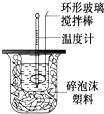 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol ( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
19.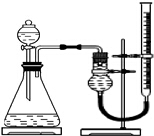 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用如图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
(1)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗,打开止水夹,上下移动有刻度的玻璃管,有刻度的玻璃管中液面高度变化,若干燥管中的液面与玻璃管中液面高度不一致,并保持一定的高度差,则气密性良好.
(2)实验①④的主要目的是证明硫酸根离子对H2O2分解无催化效果.
(3)实验②中选用试剂的体积v1=5mL.
(4)实验③中选用的试剂M是Fe2(SO4)3;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+对H2O2分解的催化效果比Cu2+对H2O2分解的催化效果更好.
 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果实验小组用如图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
(2)实验①④的主要目的是证明硫酸根离子对H2O2分解无催化效果.
(3)实验②中选用试剂的体积v1=5mL.
(4)实验③中选用的试剂M是Fe2(SO4)3;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+对H2O2分解的催化效果比Cu2+对H2O2分解的催化效果更好.
6.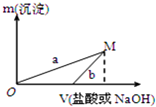 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:
方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
3.下列关于氯气的叙述中不正确的是 ( )
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 将氢气和氯气混合光照,能安静地燃烧,产生苍白色火焰 | |
| D. | 与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
20.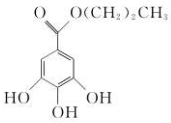 没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
 没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )| A. | 分子式为C10H13O5 | B. | 可以发生取代反应和加成反应 | ||
| C. | 易溶于水、乙醇、苯等溶剂 | D. | 装于无色玻璃瓶中,密封保存 |
9.在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol•L-1.在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍.下列说法不正确的是( )
| A. | 前2s,N2O4的平均反应速率为0.005mol•L-1•s-1 | |
| B. | 平衡时,N2O4的转化率为50% | |
| C. | 平衡时,体系内NO2为0.04mol•L-1 | |
| D. | 在2s时,体系内压强为反应前的1.1倍 |