题目内容
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
分析 电解质在熔融状态或水溶液中电离出了自由移动离子导电,金属导电是金属中自由电子定向移动导电.
解答 解:A、氯化钠熔化导电是氯化钠电离出了自由移动的离子,通电离子定向移动形成电流导电;
B、液态汞导电是金属中的自由移动电子定向移动导电,与电解质溶液或熔融电解质导电不同;
C、H2SO4溶液导电是溶液中自由移动离子通电定向移动而导电;
D、熔融状态的K0H导电是K0H电离出了自由移动的离子,通电离子定向移动形成电流导电;
B选项导电原理与其他三项导电原理不同,
故选B.
点评 不同考查了电解质溶液或熔融状态导电实质,金属导电实质分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
5.下列食品、调味品的制作过程中,没有发生化学变化的是( )
| A. |  | B. |  | C. |  | D. |  |
6.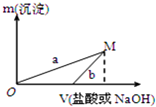 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:
方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
3.下列关于氯气的叙述中不正确的是 ( )
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 将氢气和氯气混合光照,能安静地燃烧,产生苍白色火焰 | |
| D. | 与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |
10.25℃时,将水不断滴入0.1mol/L的醋酸中,随着V(H2O)的增大,可以表示X的是( )


| A. | 溶液的导电性 | B. | c(H+) | C. | ka(CH3COOH) | D. | $\frac{c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$ |
20.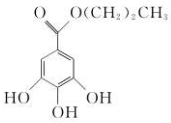 没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
 没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )
没食子酸丙酯的结构简式为,有吸湿性,对光不稳定,发生分解,耐高温性差.下列有关说法正确的是( )| A. | 分子式为C10H13O5 | B. | 可以发生取代反应和加成反应 | ||
| C. | 易溶于水、乙醇、苯等溶剂 | D. | 装于无色玻璃瓶中,密封保存 |
7.下列关于电解质溶液的说法正确的是( )
| A. | pH=3的NH4Cl溶液与pH=3的盐酸中,水电离的c(H+)相等 | |
| B. | 25℃时将0.1 mol•L-1的HF加水不断稀释,$\frac{c({H}^{+})•c({F}^{-})}{c(HF)}$减小 | |
| C. | K2SO3溶液中加入少量的Ba(OH)2固体,溶液的pH增大,SO${\;}_{3}^{2-}$水解程度减小 | |
| D. | 因为AgBr比AgCl的KSP小,所以AgCl可以转化为AgBr,但AgBr无法转化为AgCl |
