题目内容
14.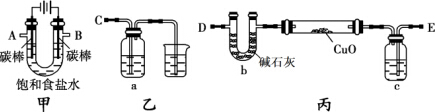 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%
甲方案:利用甲、乙装置测定饱和食盐水的电解率,
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的实验现象:左右碳棒上都有气泡产生,左边碳棒附近溶液变红.
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为B连C(填A、B、C、等导管口),则洗气瓶a中发生反应的离子方程式为Cl2+2OH-=H2O+Cl-+ClO-;.
乙方案:利用甲、丙装置测定饱和食盐水的电解率,
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率,
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①.一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与D口连接
a.A b.B c.D d.E
②.另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?请说明理由同意,在乙方案中氢气还原氧化铜,氢气不能全部反应,误差太大
丙方案:只利用甲装置测定饱和食盐水的电解率.
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率16.6%(假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g).
分析 (1)依据甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色;
(2)氢氧化钠溶液可以吸收氯气发生反应,电解池中B端为阳极生成氯气,装置B连C;
(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,应连接装置D处;
②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差;
(4)依据溶液pH计算氢氧根离子浓度结合化学方程式计算反应的氯化钠质量,利用溶解度计算150ml溶液中氯化钠的质量,用反应氯化钠质量除以原溶液中氯化钠质量得到食盐水的电解率.
解答 解:(1)甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解过程中甲装置中的实验现象为:左右碳棒上都有气泡产生,左边碳棒附近溶液变红,
故答案为:左右碳棒上都有气泡产生,左边碳棒附近溶液变红;
(2)洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,氢氧化钠溶液可以吸收氯气发生反应,电解池中B端为阳极生成氯气,装置B连C,
故答案为:B;C;Cl2+2OH-=H2O+Cl-+ClO-;
(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,应连接装置D处,
故答案为:D;
②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差,
故答案为:同意,在乙方案中氢气还原氧化铜,氢气不能全部反应,误差太大;
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.15L×1mol/L=0.15mol,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,电解的氯化钠物质的量为0.15mol,质量=0.15mol×58.5g/mol=8.775g,饱和食盐水密度约为1.33g/mL,150mL饱和食盐水质量=1.33g/mL×150ml=199.5g,依据溶解度计算溶液中含有溶质氯化钠质量=199.5g×$\frac{36g}{100g+36g}$=52.81g,电解率=$\frac{8.775g}{52.81g}$×100%=16.6%,
故答案为:16.6%.
点评 本题考查了电解原理的分析应用,电解率实验测定方案的设计方法和计算,电解质溶液中离子浓度大小比较,注意金属电解后溶液中溶质成分是关键,题目难度中等.

| A. | Ag+、Cl-、NO3-、K+ | B. | K+、Cu2+、SO42-、NO3- | ||
| C. | K+、Mg2+、Cl-、OH- | D. | NH4+、SO42-、NO3-、Na+ |
| A. |  | B. |  | C. |  | D. |  |
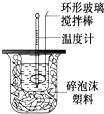 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):NaOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.a.实验装置保温、隔热效果差b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
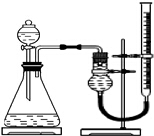 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果实验小组用如图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
(2)实验①④的主要目的是证明硫酸根离子对H2O2分解无催化效果.
(3)实验②中选用试剂的体积v1=5mL.
(4)实验③中选用的试剂M是Fe2(SO4)3;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+对H2O2分解的催化效果比Cu2+对H2O2分解的催化效果更好.
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
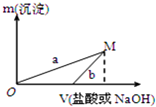
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 将氢气和氯气混合光照,能安静地燃烧,产生苍白色火焰 | |
| D. | 与氢氧化钠溶液反应时,Cl2既被还原,同时又被氧化 |