题目内容
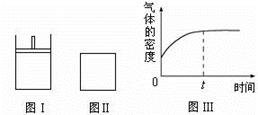
如下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):
2X(?)+ Y(?) a Z(g)。
a Z(g)。
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是

2X(?)+ Y(?)
 a Z(g)。
a Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。下列判断正确的是
| A.物质Z的化学计量数a = 2 |
| B.若X、Y均为气态,则在平衡时X的转化率:Ⅰ> Ⅱ |
| C.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y都为气态 |
| D.若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ |
B
试题分析:A .根据方程式可知:X、Y、Z的物质的量变化关系是2: 1:a。若Y改变的物质的量为x,则X物质变化2x,Z物质变化ax,所以平衡时物质的量的比为(2-2x):(2-x):ax=1∶3∶2。解得x=0.8,a=1.因此该选项错误。B.若X、Y均为气态,则该反应的正反应为气体体积减小的反应,随着反应的进行,气体的物质的量减小,容器内的气体压强减小,为了维持压强不变,就要缩小容器的容积,增大压强,平衡正向移动。由于Ⅰ是恒压,Ⅱ是恒容。所以在平衡时X的转化率:Ⅰ> Ⅱ。正确。C.由图可知:随着反应的进行 ,气体的密度逐渐增大。因为容器的容积不变,所以气体的质量增加,直至达到平衡,气体的密度不再发生变化。则X、Y中至少有一种是非气体物质。错误。D.若X为固态、Y为气态,则该反应是气体体积相等的反应。反应前后两个容器的气体的压强相等,因此Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ=Ⅱ。错误。

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
 pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定)
pC(g)处于平衡状态(已知n+m>p,△H>0)。升高温度时c(B)/c(C)的比值 ,混合气体的密度 ;降温时,混合气体的平均相对分子质量 ;加入催化剂,气体的总物质的量 ;充入C,则A、B的物质的量 。(填增大、减小、不变、不确定) 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的( )不变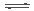 CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如右图所示。下列说法错误的是
 (g)→
(g)→ (g)+H2(g),ΔH=" +117.6" kJ/mol
(g)+H2(g),ΔH=" +117.6" kJ/mol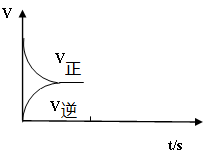
 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )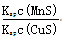
 CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH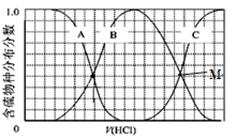
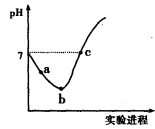
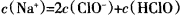
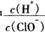 减小
减小 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。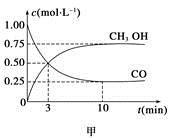
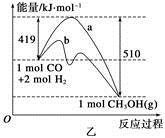
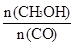 增大的有____________。
增大的有____________。