题目内容
1.下列有关原子结构和元素周期律表述正确的是( )| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
分析 A.同周期自左而右,非金属性增强;
B.原子序数为15的元素是磷元素,主族元素最高正化合价等于原子最外层电子数;
C.最外层电子数是2的元素可能为He或ⅡB族元素;
D.第二周期ⅣA族元素为碳元素,原子核电荷数一定为6,中子数不一定是6.
解答 解:A.同周期自左而右,非金属性增强,所以ⅦA族元素是同周期中非金属性最强的元素,故A正确;
B.主族元素最高正化合价等于原子最外层电子数,原子序数为15的元素是磷元素,最外层电子数为5,该元素的最高化合价为+5,故B错误;
C.最外层电子数是2的元素可能为He或ⅡB族元素,不一定为第ⅡA族元素,故C错误;
D.第二周期ⅣA族元素为碳元素,原子核电荷数一定为6,中子数不一定是6,如有核素614C,故D错误.
故选A.
点评 本题综合考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力和双基的考查,注意把握原子结构特点和元素的性质以及周期律的递变规律,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列表述正确的是( )
| A. | 含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2 HClO | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
12.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,其密度比水的小 | |
| B. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| C. | 溴乙烷与NaOH的醇溶液混合共热可生成乙烯 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
16.现有前20号的元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是146C(用元素符号表示)
元素Z的离子结构示意图为 ,化合物WXY的电子式
,化合物WXY的电子式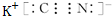 .
.
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式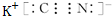 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
13.含有下列各组离子的溶液中,通入NH3后仍能大量共存的是( )
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
10.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | 室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
11.如图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液.下列说法不正确的是( )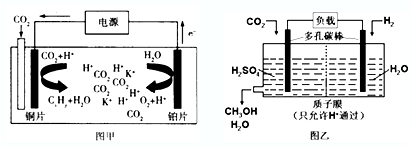

| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+6e-+6H+═CH3OH+H2O |
 Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.