题目内容
6.使用清洁能源可减少CO2、SO2,NO2等气体的排放,二甲醛和甲烷都是重要的清洁能源(1)由合成气制备二甲醚的反应原理如下:
①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kj/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kj/mol
③CO(g)+H2O?CO2(g)+H2(g)△H=-41.2kj/mol
计算反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1kj/mol
(2)将10molCO与20molH2通入密闭容器中,在一定条件下发生反应:
2CO(g)+4H2(g)=CH2OCH2(g)+H2O(g)
已知CO的平衡转化率随温度(T)、压强(p)的变化关系如图一所示
①M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ
②压强P1、P2的大小关系为P1>P2(填“>”或“<”或“=”)
(3)用CH4催化还原NO2可以减少NO2的排放,已知:CH4(g)+2NO2=N2(g)+CO2(g)+2H2O(1)△H<0
图二表示一定量的CH4和NO2混合气体在密闭容器中发生反应时c(NO2)的变化情况
①其他条件不变,升高温度,平衡向逆反应方向移动(填“正反方向”或“逆反应方向”)
②与曲线A相比,曲线B、曲线C改变的实验条件及判断依据是:B使用催化剂C增加NO2
③在曲线B图示反应后,若CH4与NO2的转化率相等,列示计算中C点反应的平衡常数K=150

分析 (1)依据盖斯定律和已知热化学方程式构建目标方程式,即根据盖斯定律:①×2+②+③,反应热和化学计量数成正比,据此分析解答;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
(3)①根据化学平衡移动原理:升高温度可以使化学平衡向吸热反应的方向移动;
②根据图象中的曲线的变化趋势判断出条件的改变,与曲线A相比,曲线B只缩短到达平衡的时间,为使用催化剂,曲线C根据NO2量分析;
③在曲线B图示反应后,若CH4与NO2的转化率相等,说明甲烷和二氧化氮投料比为化学计量数之比即1:2,B到C改变的是反应物的物质的量,但温度未变,所以C与B的平衡常数相等,依据化学平衡三段式列式计算B点平衡浓度达到平衡常数即为C点的平衡常数.
解答 解:(1)①CO( g)+2H2(g)?CH3OH( g)△H1=-90.7kJ•mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1,
故答案为:-246.1;
(2)化学平衡常数只与温度有关,相同温度时其平衡常数相等,升高温度平衡向逆反应方向移动,其平衡常数减小,根据图象知,温度:M=N<Q,则若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为KM=KN>KQ;相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1大于p2,
故答案为:KM=KN>KQ;>;
(3)①根据平衡移动原理进行分析,升高温度,平衡向吸热反应方向移动,CH4(g)+2NO2=N2(g)+CO2(g)+2H2O(1)△H<0正反应为放热反应,所以升高温度,平衡向逆反应方向移动,
故答案为:逆反应方向;
②与曲线A相比,曲线B到达平衡的时间变小,但平衡没有发生移动,所以为使用催化剂;曲线C由题中数据可知,在45秒临界点,NO2浓度从0.01mol/L瞬间变为0.0175mol/L,说明改变的量是增加NO2量,
故答案为:使用催化剂;增加NO2;
③B到C改变的是反应物的物质的量,但温度未变,所以C与B的平衡常数相等,在曲线B图示反应后,若CH4与NO2的转化率相等,说明甲烷和二氧化氮投料比为化学计量数之比即1:2,在B点:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1)
起始量(mol/L) 0.02 0.04
变化量(mol/L) 0.015 0.03 0.015 0.015
平衡量(mol/L) 0.005 0.01 0.015 0.015
K=$\frac{c({N}_{2})c(C{O}_{2})}{c(C{H}_{4}){c}^{2}(N{O}_{2})}$=$\frac{0.015×0.015}{0.005×0.0{1}^{2}}$=150,即C点的平衡常数为150,
故答案为:150.
点评 本题考查反应热的计算、转化率与温度、压强关系,明确温度、压强对该反应平衡影响是解本题关键,题目难度中等.

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案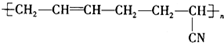 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④CH3-CH=CH-CN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3.
| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
| A. | 离子化合物一定易溶于水 | |
| B. | 离子化合物由非金属元素和金属元素共同组成 | |
| C. | 熔融状态下能够导电的物质,一定是离子化合物 | |
| D. | 离子化合物在固态时有离子存在,但不导电 |
| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
| A. | 元素周期表有7个主族,8个副族,1个0族 | |
| B. | 同周期元素原子的最外层电子数相同 | |
| C. | 同主族元素从上到下原子半径依次减小 | |
| D. | 金属元素和非金属元素分界线附近的元素可用于制造半导体材料 |
| A. | 强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| B. | 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | c(OH-)=1×10-13 mol/L的溶液中:K+、Fe2+、Cl-、NO3- |
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO制备HClO |
| A. | A | B. | B | C. | C | D. | D |
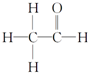 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1.