题目内容
11.下列表述正确的是( )| A. | 含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2 HClO | |
| D. | 在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |
分析 A.AlO2-水解呈碱性;
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)为吸热反应;
C.发生氧化还原反应生成硫酸钙;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,说明不含SiO32-,应含有I-、NO3-发生氧化还原反应,可生成NO,不一定为二氧化碳气体.
解答 解:A.AlO2-水解呈碱性,Al3+、HCO3-不能大量共存,故A错误;
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)为吸热反应,△H=+566.0kJ/mol,故B正确;
C.发生氧化还原反应生成硫酸钙,离子方程式为Ca2++ClO-+SO2+H2O=CaSO4↓+2H++Cl-,故C错误;
D.当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,说明不含SiO32-,应含有I-、NO3-发生氧化还原反应,可生成NO,阴离子种数减少3种,可能含有SO32-,不一定有CO32-,故D错误.
故选B.
点评 本题考查较为综合,涉及离子共存、热化学方程式以及氧化还原反应等问题,为高频考点,侧重学生的分析能力的考查,题目难度中等,本题注意把握相关题给信息,为解答该类题目的关键,学习中注重相关基础知识的积累.

练习册系列答案
相关题目
2.下列关于元素周期表的叙述,不正确的是( )
| A. | 共有7个周期,16个族 | |
| B. | 形成化合物种类最多的元素在第2周期 | |
| C. | 第ⅡA族的右边是第ⅢB族,第ⅢA族的左边是第ⅡB族 | |
| D. | 某主族元素最高价氧化物对应的水化物的化学式为HnROm,其气态氢化物的化学式一定为H2m-nR或RH2m-n |
19.下列说法正确的是( )
| A. | H2O和H2O2中的化学键类型完全相同 | |
| B. | N2的结构式为N-N | |
| C. | 一个D216O分子所含的中子数为10 | |
| D. | NaCl的电子式为  |
6.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则 H2SO4 和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
16.丁腈橡胶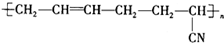 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④CH3-CH=CH-CN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3.
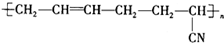 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )①CH2=CH-CH=CH2 ②CH3-C≡C-CH3 ③CH2=CH-CN
④CH3-CH=CH-CN ⑤CH3-CH=CH2 ⑥CH3-CH=CH-CH3.
| A. | ③⑥ | B. | ②③ | C. | ①③ | D. | ④⑤ |
3.下列各物质中,互为同系物的是( )
| A. | CH3-CH2-CH2-CH3与 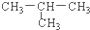 | B. | C3H8与C6H14 | ||
| C. | 乙烯和1,3-丁二烯 | D. | CH3CH2Cl 和CH2ClCH2CH2Cl |
20.某同学对一透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )
| A. | Al3+、NO3-、K+、SO42ˉ | B. | Ca2+、H+、CO32ˉ、AlO2- | ||
| C. | OH-、SO42-、NH4+、Ag+ | D. | Fe2+、Mg2+、H+、NO3ˉ |
1.下列有关原子结构和元素周期律表述正确的是( )
| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白: