题目内容
【题目】在室温下,下列五种溶液:
①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液 ⑤0.1 mol·L-1 NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈___(填“酸”“碱”或“中”)性,其原因是____________(用离子方程式表示)。
(2)比较溶液②③中c (NH4+)②____________③(填“>”、“<”或“=”)
(3)在溶液④中,___的浓度为0.1 mol·L-1(填选项);NH3·H2O和_____离子的浓度之和为0.2 mol·L-1。(填选项)
A .c (NH4+) B. c (Cl-)
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度___NH4+的水解程度,(填“>”“<”或“=”),c(CH3COO-)_____ c(NH4+) (填“>”“<”或“=”)。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ < B A = =
NH3·H2O+H+ < B A = =
【解析】
(1)溶液①0.1 mol·L-1 NH4Cl 呈酸性,原因是铵根离子为弱碱阳离子,水解呈酸性,用离子方程式表示:NH4++H2O![]() NH3·H2O+H+,故答案为:酸;NH4++H2O
NH3·H2O+H+,故答案为:酸;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(2)比较溶液②0.1 mol·L-1 CH3COONH4 ③0.1 mol·L-1 NH4HSO4中c (NH4+),前者是弱酸弱碱盐,醋酸根离子促进铵根离子水解,后者溶液中的氢离子抑制铵根离子水解,c (NH4+):②<③,故答案为:<;
(3)在溶液④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液中,c (Cl-)的浓度为0.1 mol·L-1,故选B;
根据物料守恒:NH3·H2O和c (NH4+)离子的浓度之和为0.2 mol·L-1,故选A;
故答案为:B;A;
(4)室温下,测得溶液②0.1 mol·L-1 CH3COONH4的pH=7,c(OH-) =c(H+),由电荷守恒:c(CH3COO-)+c(OH-) =c(H+)+c(NH4+),则说明CH3COO-的水解程度等于NH4+的水解程度,c(CH3COO-)= c(NH4+)。
故答案为:=;=。

【题目】我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
雨水的pH | 4.75 | 4.62 | 4.56 | 4.55 | 4.54 |
分析数据,回答以下问题:
①雨水样品呈酸性的原因是________________________________(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水(含有氯气)混合,pH将________(填“变大”“变小”或“不变”)。
(2)测定雨水样品时,每隔一定时间测定一次pH,发现pH逐渐变小,其原因可能是_______(用化学方程式表示)。
(3)举一例说明这种雨水将给环境中的生物或非生物造成的影响________________。
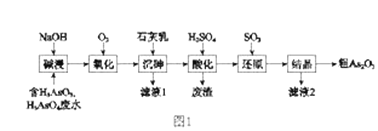
【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。