题目内容
19.甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大.甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)A的电子式为
 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.(2)溴元素在周期表的位置第四周期ⅦA族丁元素的阴离子结构示意图为
 .
.(3)甲、乙、丙、丁四元素的离子半径由大到小的顺序为(用离子符号表示)S2->O2->Na+>H+;甲、乙、丙、丁四元素的第一电离能由大到小的顺序为(用元素符号表示)O>S>H>Na.
(4)F分子的空间构型为V形;H分子的空间构型为平面三角形.
分析 甲和乙可形成常见液态化合物K,H溶于K中可得溶液,则K为H2O,根据原子序数可知甲为H元素,乙为O元素,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丙为Na元素,A为Na2O2,则C为NaOH,D为O2,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数比丙大,应为S元素,气体F能与溴水和氧气反应,说明具有还原性,应为SO2,和氧气反应生成SO3,则E为H2SO4,固体B应为Na2SO3,G为Na2SO4,L为HBr,结合对应物质的性质解答该题.
解答 解:甲和乙可形成常见液态化合物K,H溶于K中可得溶液,则K为H2O,根据原子序数可知甲为H元素,乙为O元素,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丙为Na元素,A为Na2O2,则C为NaOH,D为O2,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数比丙大,应为S元素,气体F能与溴水和氧气反应,说明具有还原性,应为SO2,和氧气反应生成SO3,则E为H2SO4,固体B应为Na2SO3,G为Na2SO4,L为HBr,
(1)A为Na2O2,为离子化合物,电子式为
故答案为:
(2)溴的原子序数为35,原子核外有4个电子层,最外层电子数为7,位于周期表第四周期ⅦA族,丁为S元素,对应阴离子核外由3个电子层,最外层电子数为8,离子的结构示意图为 ,故答案为:第四周期ⅦA族;
,故答案为:第四周期ⅦA族; ;
;
(3)甲为H元素,离子半径最小,乙、丙、丁三元素的离子分别为O2-、Na+、S2-,O2-、Na+具有相同的核外电子排布,核电核数越大,半径越小,则离子半径O2->Na+,核外电子层数最多,半径最大,则四种离子的半径由大到小的顺序为S2->O2->Na+>H+,同周期元素从左到右,第一电离能逐渐增大,同主族元素从上到下,第一电离能逐渐减小,为O>S>H>Na,
故答案为:S2->O2->Na+>H+;O>S>H>Na;
(4)F为SO2,含有2个σ键,孤对电子数为$\frac{6-2×2}{2}$=1,为V形结构,H为SO3,含有3个σ键,没有孤对电子,为平面三角形,故答案为:V形;平面三角形.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,本题在推断时注意原子结构特征,为解答该题的关键,注意相关元素化合物的性质.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 只能是离子化合物X2Y | |
| B. | 只能是共价化合物X2Y2 | |
| C. | 既可能是离子化合物也可能是共价化合物 | |
| D. | 形成的化合物无论是X2Y还是X2Y2 原子都达到了8电子稳定结构 |
| A. | 反应结束后溶液的pH:甲>乙 | |
| B. | 反应开始时的速率:甲>乙 | |
| C. | 反应所需时间:甲<乙 | |
| D. | 反应开始时,酸的物质的量浓度:甲>乙 |
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应可以设计成原电池来提供电能 |
| A. | 实验室用碱石灰吸收SO2 | B. | CO2与澄清石灰水作用 | ||
| C. | N2O5与水反应制备HNO3 | D. | Na2O2与水反应制备氧气 |
 所示.下列关于有机物 I的说法正确的是CD.
所示.下列关于有机物 I的说法正确的是CD.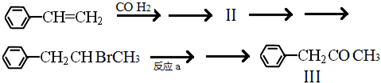
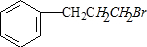 ;
; ;
; +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr. 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.