题目内容
9.(1)某有机物I的结构简式如图 所示.下列关于有机物 I的说法正确的是CD.
所示.下列关于有机物 I的说法正确的是CD.A.分子式为C14H12O5Cl;
B.1molI最多可消耗5molNaOH;
C.可以发生加聚、氧化、取代、消去反应;D.难溶于水.
(2)已知在一定条件下烯、炔可以与CO、H2反应生成醛,如:CH≡CH+CO+H2→CH2=CHCHO.以苯乙烯为原料按以下路径可以合成有机物Ⅲ:
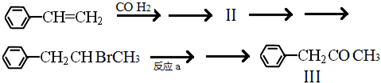
①上述流程第一步反应还可以得到另一种有机产物,其结构简式为:
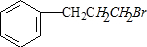 ;
;②Ⅱ的结构简式为:
 ;
;③反应a的化学方程式为:
 +NaOH
+NaOH +NaBr.
+NaBr.④Ⅲ的同分异构体中满足以下条件的有2种.加入氯化铁溶液显紫色;能发生加聚反应;苯环上的一元取代产物有两种.
(3)仅以乙烯为有机原料,合成(CH3)2CHCHO,写出有关反应的化学方程式(不要求写出反应条件).
分析 (1)分子中含有两个酚羟基、1个苯环、1个碳碳双键和两个酯基,据此判断其具有的性质;
(2) 与CO、H2发生信息反应生成
与CO、H2发生信息反应生成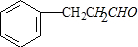 ,
,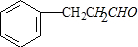 与氢气发生加成反应生成化合物Ⅱ:
与氢气发生加成反应生成化合物Ⅱ: ,
, 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成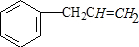 ,
,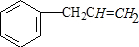 与HBr发生加成反应生成
与HBr发生加成反应生成 ,
, 在氢氧化钠的水溶液中加热反应生成
在氢氧化钠的水溶液中加热反应生成 ,
, 催化氧化生成
催化氧化生成 ,据此进行解答(1)(2);
,据此进行解答(1)(2);
(3)CH2=CH2合成(CH3)2CHCHO,碳原子数增加2个,结合题中反应原理可知,乙烯先与CO、H2反应生成丙醛,然后CH3CH2CHO发生还原反应生成生成1-丙醇,丙醇发生消去反应生成丙烯,最后CH2=CHCH3与CO、H2反应生成(CH3)2CHCHO.
解答 解:(1)A. 分子中含有14个C、15个H、6个O和1个Cl原子,其分子式为C14H15O6Cl,故A错误;
分子中含有14个C、15个H、6个O和1个Cl原子,其分子式为C14H15O6Cl,故A错误;
B.1molⅠ 分解后含有3mol酚羟基、2mol羧基和1molCl原子,总共能够消耗6mol氢氧化钠,故B错误;
分解后含有3mol酚羟基、2mol羧基和1molCl原子,总共能够消耗6mol氢氧化钠,故B错误;
C.该有机物分子中含有碳碳双键,能够发生加聚反应;含有酯基和Cl原子,能够发生取代反应;含有碳碳双键,能够发生氧化反应;含有氯原子,能够发生消去反应,故C正确;
D.该有机物分子中含有酯基、卤素原子,酯类、卤代烃难溶于水,故D正确;
故答案为:CD;
(2) 与CO、H2发生信息反应生成
与CO、H2发生信息反应生成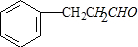 ,
,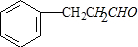 与氢气发生加成反应生成化合物Ⅱ:
与氢气发生加成反应生成化合物Ⅱ: ,
, 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成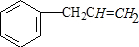 ,
,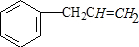 与HBr发生加成反应生成
与HBr发生加成反应生成 ,
, 在氢氧化钠的水溶液中加热反应生成
在氢氧化钠的水溶液中加热反应生成 ,
, 催化氧化生成
催化氧化生成 ,
,
①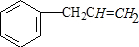 与HBr发生加成反应除了生成
与HBr发生加成反应除了生成 ,还能够生成
,还能够生成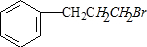 ,
,
故答案为: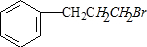 ;
;
②根据分析可知,②Ⅱ的结构简式为: ,故答案为:
,故答案为: ;
;
③反应a为 在氢氧化钠的水溶液中加热反应生成
在氢氧化钠的水溶液中加热反应生成 ,反应的化学方程式为:
,反应的化学方程式为: +NaOH
+NaOH +NaBr,
+NaBr,
故答案为: +NaOH
+NaOH +NaBr;
+NaBr;
④Ⅲ的结构简式为 ,加入氯化铁溶液显紫色,说明分子中含有酚羟基;能发生加聚反应,有机物分子中含有碳碳双键;苯环上的一元取代产物有两种,说明有机物具有对称结构,即在苯环的对位含有两个取代基,可能为-OH和-CH=CHCH3或-OH和-CH2CH=CH2,总共有2种结构,
,加入氯化铁溶液显紫色,说明分子中含有酚羟基;能发生加聚反应,有机物分子中含有碳碳双键;苯环上的一元取代产物有两种,说明有机物具有对称结构,即在苯环的对位含有两个取代基,可能为-OH和-CH=CHCH3或-OH和-CH2CH=CH2,总共有2种结构,
故答案为:2;
(3)CH2=CH2合成(CH3)2CHCHO,碳原子数增加2个,结合题中反应原理可知,乙烯先与CO、H2反应生成丙醛CH3CH2CHO,反应方程式为:CH2=CH2+CO+H2→CH3CH2CHO,然后CH3CH2CHO发生还原反应生成生成1-丙醇:CH3CH2CHO+H2→CH3CH2CH2OH,丙醇发生消去反应生成丙烯:CH3CH2CH2OH→CH2=CHCH3+H2O,最后CH2=CHCH3与CO、H2反应生成(CH3)2CHCHO,反应方程式为:CH2=CHCH3+CO+H2→(CH3)2CHCHO,
答:CH2=CH2+CO+H2→CH3CH2CHO、CH3CH2CHO+H2→CH3CH2CH2OH、CH3CH2CH2OH→CH2=CHCH3+H2O、CH2=CHCH3+CO+H2→(CH3)2CHCHO.
点评 本题考查了有机合成,题目难度中等,明确合成原理为解答关键,注意掌握常见有机物结构与性质,(3)为难点,注意成分利用题中反应原理,试题侧重考查学生的分析、理解能力及逻辑推理能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案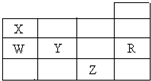
| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物的稳定性比X的氢化物的稳定性高 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
| A. | Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| B. | 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入装有足量氯化钡溶液的洗气瓶中(如图装置),洗气瓶中产生的沉淀是硫酸钡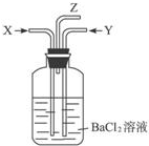 | |
| C. | 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 | |
| D. | 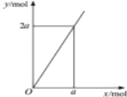 锌与不同浓度的硝酸可发生不同的反应(如图:y表示耗去Zn的物质的量,x表示被还原的硝酸的物质的量),4Zn+10HNO3(极稀)=4Zn(NO3)2+5H2O+N2O↑符合图示 |
| A. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热--检验混合物中是否含有甲醛 | |
| B. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
| A. | 引进电动汽车,减少汽车尾气排放 | |
| B. | 大力发展火电,缓解用电紧张 | |
| C. | 开发太阳能、风能、氢能等清洁能源 | |
| D. | 积极推行和使用能被微生物降解的新型聚合物材料 |
| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
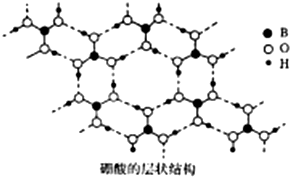 硼(B)及其化合物在化学中有重要的地位.请回答下列问题:
硼(B)及其化合物在化学中有重要的地位.请回答下列问题: [B(OH)4]-+H+.
[B(OH)4]-+H+.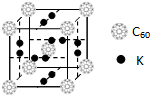 碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关.
碳元素是构成物质种类最多的一种元素,许多物质与我们的生活息息相关. ,该物质的K原子和C60分子的个数比为3:1.
,该物质的K原子和C60分子的个数比为3:1.
 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.