题目内容
8.某溶液仅含下列离子中的几种,且所含各种离子的物质的量浓度均为0.lmol/L(忽略水的电离及离子的水解).K+ Ag+ Mg2+ Al3+ NH4+ Cl- CO32- NO3- SO42- I-用如下各步实验分析该溶液组成:
①取5mL溶液,滴少量稀氨水,发现溶液中有沉淀生成,且离子种类增加.
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,火焰不显紫色.
③另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
④向步骤③实验所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请回答下列问题:
(1)由步骤②判断,溶液中一定不含有的阳离子是K+;步骤③中生成无色气体的化学式是NO
(2)最终确定溶液中所含阴离子有Cl-、I-、NO3-、SO42-
(3)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体化学式为MgO.
分析 ①取该无色溶液5mL,说明一定不含有色的Cu2+,滴加一滴氨水有沉淀生成,且离子种类增加,说明增加的是NH4+,所以原溶液中一定不含NH4+,可能含有Mg2+、Al3+,不含NH4+,CO32-;
②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明溶液中不含K+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明有还原性离子I-与NO3-、H+反应生成NO,即溶液中有I-、NO3-;判断一定不含有Ag+;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42-;
根据以上分析进行解答.
解答 解:根据①取该无色溶液5mL可知一定不含有Cu2+,滴加一滴氨水有沉淀生成,且离子种类增加,说明增加的是NH4+,所以原溶液中一定不含NH4+,可能含有Mg2+、Al3+,不含NH4+,CO32-;②用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明没有K+; ③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明有还原性离子I-与NO3-、H+反应生成NO,即溶液中有I-、NO3-;判断一定不含有Ag+;④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42-,
(1)用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钻玻璃观察,无紫色火焰,说明没有K+;③中加入少量盐酸生成无色气体,是I-与NO3-和H+反应生成NO,其离子方程式为:6I-+2NO3-+8H+═3I2+2NO↑+4H2O,
故答案为:K+;NO;
(2)由上述分析可知一定含有的阴离子I-、NO3-,SO42-,且各为0.1mol/L,依据电荷守恒可知,推断出的阳离子含有Mg2+、Al3+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种-1价的阴离子为Cl-,所以甲同学最终确定原溶液中所含阳离子是:Mg2+、Al3+,阴离子是:Cl-、I-、NO3-、SO42-,
故答案为:Cl-、I-、NO3-、SO42-;
(3)另取100mL原溶液,加入足量的NaOH溶液,Mg2+、Al3+ 反应生成Mg(OH)2,NaAlO2,涉及的离子方程式为Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O,充分反应后过滤,洗涤,灼烧沉淀至恒重,沉淀为氢氧化镁,最终得到的固体为MgO,
故答案为:MgO.
点评 本题考查了常见离子的检验,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意掌握某些特殊离子具有的性质,如颜色、两性、焰色反应的火焰颜色等,常常为此类题的突破口.

| A. | 燃烧反应都是放热反应 | |
| B. | 对于可逆反应:aA(g)+bB(g)?bC(g)+dD(g),如果正反应放热,逆反应一定吸热 | |
| C. | 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 | |
| D. | 只有放热的氧化还原反应才可以设计为原电池 |
| A. | 金刚石和石墨 | B. | 白磷和红磷 | C. | 正丁烷和异丁烷 | D. | O2和O3 |
| A. | $\frac{b-2c}{a}$ | B. | $\frac{b-2c}{2a}$ | C. | $\frac{2b-c}{a}$ | D. | $\frac{2b-4c}{a}$ |
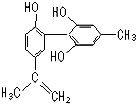 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
| A. | 因为放在烧杯中称量比放在纸上称量更准确 | |
| B. | 因为配制溶液是在烧杯中进行,直接放在烧杯中称量会减少操作过程 | |
| C. | 因NaOH易潮解且有强腐蚀性 | |
| D. | 因为放在纸上称量会混有杂质,降低所配制溶液的纯度 |

 ;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1.
;所含化学键类型为离子键、共价键(或离子键、非极性键);A晶体的晶胞中阳离子和阴离子的个数比为2:1. .
.
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.