题目内容
8.将100mL、2mol/L的Na2CO3与100mL、0.8mol/L的盐酸按下面两种方式混合:①将盐酸滴加到碳酸钠溶液中;
②将碳酸钠溶液滴加到盐酸中.
则两种情况下生成的二氧化碳的物质的量(mol)分别为( )
| A. | 0.04 0.04 | B. | 0 0.04 | C. | 0.2 0.2 | D. | 0 1 |
分析 100mL、2mol/L的Na2CO3中n(Na2CO3)=0.2mol,100mL、0.8mol/L的盐酸中n(HCl)=0.08mol,
①将HCl滴加到碳酸钠溶液中,先发生Na2CO3+HCl=NaHCO3+NaCl,然后发生NaHCO3+HCl=NaCl+CO2↑+H2O,
②Na2CO3溶液中加入盐酸,反应的方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,
根据碳酸钠与HCl的物质的量结合方程式计算.
解答 解:100mL、2mol/L的Na2CO3中n(Na2CO3)=0.2mol,100mL、0.8mol/L的盐酸中n(HCl)=0.08mol,
①将HCl滴加到碳酸钠溶液中,先发生Na2CO3+HCl=NaHCO3+NaCl,然后发生NaHCO3+HCl=NaCl+CO2↑+H2O,
由Na2CO3+HCl=NaHCO3+NaCl可知,0.2molNa2CO3消耗HCl0.2mol,而已知HCl的物质的量为0.08mol,则HCl不足,所以不发生NaHCO3+HCl=NaCl+CO2↑+H2O,即没有二氧化碳生成,所以生成的二氧化碳的物质的量为0;
②Na2CO3溶液中加入盐酸,反应的方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,
由方程式可知,0.2molNa2CO3消耗HCl0.4mol,而已知HCl的物质的量为0.08mol,则HCl不足,按照方程式可得,n(CO2)=$\frac{1}{2}$n(HCl)=0.04mol;
故选B.
点评 本题考查化学方程式的计算,题目难度不大,本题注意Na2CO3与盐酸反应时滴加顺序不同发生的反应不同.

练习册系列答案
相关题目
2.下列有关平衡常数的说法中,正确的是( )
| A. | 改变条件,反应物的转化率增大,平衡常数也一定增大 | |
| B. | 反应2NO2(g)═N2O4(g)△H<0,升高温度该反应平衡常数增大 | |
| C. | 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 | |
| D. | 平衡常数为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$的反应,化学方程式为CO2+H2$?_{加热}^{催化剂}$CO+H2O |
3.下列说法中正确的是( )
| A. | 淀粉和纤维素都属于纯净物 | |
| B. | 油脂是含热能很高的营养物质 | |
| C. | 人体摄入的微量元素越多越有利于健康 | |
| D. | 棉花、人造丝、蚕丝的主要成分都属于蛋白质 |
13.硫酸、硝酸都是重要的化工原料,下列实验事实与浓硫酸或硝酸性质不相对应的一组是( )
| A. | 用铝槽车盛运浓硫酸--强氧化性 | |
| B. | 久置浓硝酸变黄--不稳定性 | |
| C. | 浓硫酸能使蔗糖变黑并膨胀--吸水性 | |
| D. | 用稀硝酸洗涤做过银镜反应的试管--强氧化性和酸性 |
20.与50mL 0.1molL-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
| A. | 50mL 0.2mol•L-1 的NaCl溶液 | |
| B. | 100mL 0.05mol•L-1 的NaCl溶液 | |
| C. | 25mL 0.2mol•L-1 的Na2SO4溶液 | |
| D. | 1.06g Na2CO3固体溶于水配成 100mL溶液 |
17.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | Al在氧气中生成Al2O3,Fe在氧气中也生成Fe2O3 | |
| B. | 第VA族氢化物的熔沸点顺序是NH3>AsH3>PH3;则第 VIA族氢化物的熔沸点顺序也是H2O>H2Se>H2S | |
| C. | 工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
18.下列说法正确的是( )
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
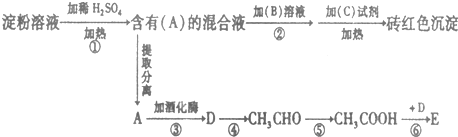
 ;
;