题目内容
20.与50mL 0.1molL-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )| A. | 50mL 0.2mol•L-1 的NaCl溶液 | |
| B. | 100mL 0.05mol•L-1 的NaCl溶液 | |
| C. | 25mL 0.2mol•L-1 的Na2SO4溶液 | |
| D. | 1.06g Na2CO3固体溶于水配成 100mL溶液 |
分析 50mL 0.1molL-1 Na2CO3 溶液中Na+的物质的量浓度为0.2mol/L,溶液中钠离子的浓度与溶液的体积大小无关,与溶质的浓度及溶质的化学式组成有关,据此对各选项进行判断.
解答 解:50mL 0.1molL-1 Na2CO3 溶液中Na+的物质的量浓度为0.2mol/L,
A.50mL 0.2mol•L-1 的NaCl溶液中含有的钠离子浓度为0.2mol/L,故A正确;
B.100mL 0.05mol•L-1 的NaCl溶液中含有的钠离子浓度为0.05mol/L,故B错误;
C.25mL 0.2mol•L-1 的Na2SO4溶液中含有的钠离子浓度为:0.2mol/L×2=0.4mol/L,故C错误;
D.1.06g Na2CO3固体溶于水配成 100mL溶液:1.0g碳酸钠的物质的量为:$\frac{1.06g}{106g/mol}$=0.01mol,0.01mol碳酸钠中含有0.02mol钠离子,则所得溶液中钠离子的浓度为:$\frac{0.02mol}{0.1L}$=0.2mol/L,故D正确;
故选AD.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意钠离子的物质的量浓度与溶液体积大小无关,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
10.400℃时,往一密闭容器中通入 4molSO2和 2molO2,反应达到平衡时,容器内压强是反应前的四分之三.此时 SO2的转化率为( )
| A. | 75% | B. | 25% | C. | 37.5% | D. | 81% |
11.实验过程中下列操作正确的是( )
| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
8.将100mL、2mol/L的Na2CO3与100mL、0.8mol/L的盐酸按下面两种方式混合:
①将盐酸滴加到碳酸钠溶液中;
②将碳酸钠溶液滴加到盐酸中.
则两种情况下生成的二氧化碳的物质的量(mol)分别为( )
①将盐酸滴加到碳酸钠溶液中;
②将碳酸钠溶液滴加到盐酸中.
则两种情况下生成的二氧化碳的物质的量(mol)分别为( )
| A. | 0.04 0.04 | B. | 0 0.04 | C. | 0.2 0.2 | D. | 0 1 |
15.下面有关氧化还原反应的叙述中,正确的是( )
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 反应中电子可以在同种元素间转移 | |
| C. | 非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
12.某实验小组需要1mol/L的Na2CO3溶液960mL,欲配制所需溶液时应选用容量瓶的规格和称量的样品质量分别为( )
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |
9.许多氧化物在一定条件下都能与Na2O2反应,且反应极有规律,如,Na2O2+SO2═Na2SO4 2Na2O2+2SO3═2Na2SO4+O2,据此你认为下列反应方程式正确的是( )
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
10.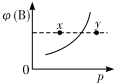 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点的混合物中v(正)<v(逆) | D. | x点比y点的正反应速率小 |
 如图为某品牌酱油标签的一部分:
如图为某品牌酱油标签的一部分: