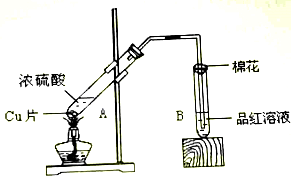
题目内容
18.下列各组气体,常温下因发生非氧化还原反应而不能共存的是( )| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |
分析 A.氯化氢和氨气反应生成氯化铵,没有元素的化合价变化;
B.二氧化硫和氧气在常温下不反应;
C.NO2、NO之间在常温下不反应;
D.氢气和氯气在常温下不反应.
解答 解:A.HCl、NH3反应生成氯化铵,没有元素的化合价变化,则发生非氧化还原反应而不能共存,故A正确;
B.SO2、O2之间在常温下不发生反应,能够共存,故B错误;
C.NO2、NO之间在常温下不发生反应,能够共存,故C错误;
D.H2、Cl2之间在常温下不反应,能够大量共存,故D错误;
故选A.
点评 本题考查氧化还原反应的应用、粒子共存的判断,为高频考点,题目难度中等,把握发生的反应及反应中元素的化合价变化为解答的关键,注意从化合价角度分析.

练习册系列答案
相关题目
8.对于溶液中的反应:MnO4-+5Fe2++8H+═5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
| A. | 加水 | B. | 增加同浓度FeSO4溶液的用量 | ||
| C. | 向溶液中滴加稀硫酸 | D. | 加入少量KMnO4晶体 |
9.乙醇分子中不同的化学键如图: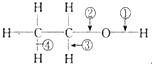 下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )
下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )
 下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )
下列关于乙醇在各种不同反应中断裂键的说明中,正确的是( )| A. | 和金属钠反应,键③断裂 | B. | 和金属钠反应,键②断裂 | ||
| C. | 在Cu催化下和O2反应,键①、③断裂 | D. | 在Cu催化下和O2反应,键②、③断裂 |
6.下列说法正确的是( )
| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
13.下列能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
3.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
7.下表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式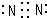 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅣA族.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
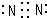 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅣA族.
8.在150℃时碳酸铵可以受热完全分解,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍( )
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |