题目内容
7.下表列出了A~R九种元素在周期表的位置:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
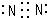 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅣA族.
分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、H为Si、R为氮、F为氧、I为硫、G为Cl,
(1)R元素单质为N2,分子中N原子之间形成2对共用电子对;A的最高价氧化物对应的水化物为NaOH,由钠离子与氢氧根离子构成;
(2)金属性越强,最高价氧化物对应水化物的碱性越强;非金属性越强,氢化物越稳定;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)钠与水反应生成氢氧化钠与氢气;
(5)上述元素中X的原子核里有14个中子,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应,可推知X为Al,而2.7gX在氧气里燃烧时,参加反应氧气为2.4g,符合题意.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、H为Si、R为氮、F为氧、I为硫、G为Cl,
(1)R单质为N2,分子中N原子之间形成3对共用电子对,其电子式为: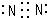 ,
,
故答案为: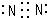 ;
;
(2)同周期自左而右金属性减弱,故金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Na+>Mg2+,
故答案为:K+>Na+>Mg2+;
(4)钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(5)上述元素中X的原子核里有14个中子,X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应,可推知X为Al,而2.7gX在氧气里燃烧时,参加反应氧气为2.4g,符合题意; Al的原子结构示意图为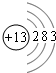 ,则其位于第三周期ⅣA族,
,则其位于第三周期ⅣA族,
故答案为:Al;三;ⅣA.
点评 本题考查元素周期表与元素周期律的应用,题目难度中等,侧重对化学用语的考查,注意整体把握元素周期表的结构,掌握微粒半径比较规律与元素周期律.

| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
| A. | 苯甲醇和甲基苯苯酚 | B. | 乙醇和乙醚 | ||
| C. | 丁二烯和2-丁烯 | D. | 乙醇和乙二醇 |
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: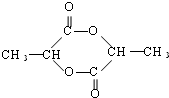 +2H2O.
+2H2O.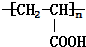 .
.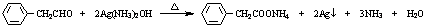 .
.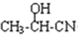 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$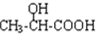 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;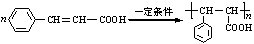 .
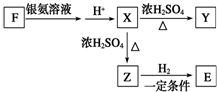
.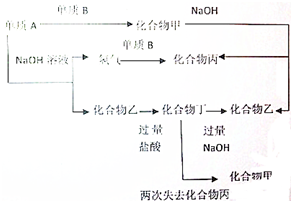 下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断:
下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断: