题目内容
8.对于溶液中的反应:MnO4-+5Fe2++8H+═5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )| A. | 加水 | B. | 增加同浓度FeSO4溶液的用量 | ||
| C. | 向溶液中滴加稀硫酸 | D. | 加入少量KMnO4晶体 |
分析 对于反应MnO4-+5Fe2++8H+═5Fe3++Mn2++4H2O来说,增大氢离子、MnO4-和Fe2+的浓度可增大反应速率,以此解答该题.
解答 解:A.加水相当于稀释使盐酸的浓度减小,从而使反应速率减慢,故A错误;
B.增加同浓度FeSO4溶液的用量,Fe2+的浓度没有增大,化学反应速率没有提高,故B错误;
C.滴加稀硫酸,氢离子浓度没有增大,化学反应速率没有提高,故C错误;
D.加入少量KMnO4晶体相当于提高MnO4-的浓度,化学反应速率提高,故D正确.
故选D.
点评 本题考查化学反应速率,为高考高频考点,侧重于反应速率的影响因素的考查以及数据处理能力,能较好的培养学生良好的科学素养,难度不大,学习中注意掌握影响化学反应速率的因素.

练习册系列答案
相关题目
18.下列叙述正确的是( )
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | CH3COONa溶液中滴加浓盐酸后c(CH3COO-)增大 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 | |
| D. | 25℃时,pH=3的HCl溶液和pH=11的NaOH溶液中,H2O的电离程度相同 |
19.由乙烯推测丙烯(CH2=CH-CH3)的结构或性质正确的是( )
| A. | 不能使酸性高锰酸钾溶液褪色 | |
| B. | 不能在空气中燃烧 | |
| C. | 能使溴水褪色 | |
| D. | 与HCl在一定条件下能加成只得到一种产物 |
16.下列物质与其用途相符合的是( )
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
①NaClO-漂白纺织物 ②NaHCO3-治疗胃酸过多 ③明矾-做干燥剂 ④硅-做光导纤维 ⑤Na2O2-呼吸面具的供氧剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④⑤ | D. | 全部 |
3.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2- (1:2:3:1) | B. | K+、Cu2+、OH-、SO42- (1:1:1:1) | ||
| C. | NH4+、H+、I -、HCO3- (1:1:1:1) | D. | Na+、Al 3+、Cl -、OH-(4:1:3:4) |
13.下列离子方程式书写不正确的是( )
| A. | 向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O | |
| B. | 小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| C. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| D. | 检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
18.下列各组气体,常温下因发生非氧化还原反应而不能共存的是( )
| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |

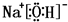 或
或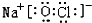 等
等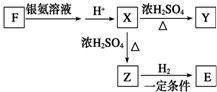 已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题:
已知由C、H、O三种元素组成的化合物A,其相对分子质量为60,且A能与NaHCO3反应生成CO2.请回答下列问题: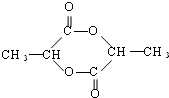 +2H2O.
+2H2O.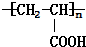 .
.