题目内容
10.某校化学小组的同学用如图装置对铜和浓硫酸在一定条件下的反应进行实验探究.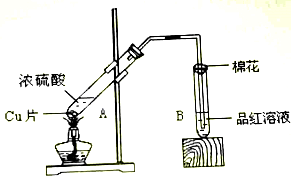
(1)写出A试管中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)若1mol铜完全反应,则被还原的H2SO4的物质的量为1mol.
分析 (1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水;
(2)该反应中Cu元素化合价由0价变为+2价,硫酸中S元素化合价由+6价变为+4价,根据转移电子守恒计算被还原硫酸物质的量.
解答 解:(1)加热条件下,浓硫酸和Cu发生氧化还原反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;
(2)该反应中Cu元素化合价由0价变为+2价,硫酸中S元素化合价由+6价变为+4价,有1molCu参加反应转移2mol电子,根据转移电子守恒知,反应中n(Cu)=n[H2SO4(被还原)]=1mol,
故答案为:1mol.
点评 本题以浓硫酸和铜的反应为载体考查化学方程式的计算及浓硫酸的性质,正确书写方程式是解本题关键,知道该反应中浓硫酸的作用,利用转移电子守恒进行计算,也可以根据方程式计算,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列有关图表示的反应叙述正确的是( )
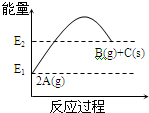

| A. | 1molC(s)的能量高于2molA(g)能量 | |
| B. | 该反应的热化学方程式为:2A(g)═B(g)+C(s)△H=(E1-E2)kJ/mol | |
| C. | 反应过程中当v(A)=0.4mol/(L•s),则v(C)=0.2mol/(L•s) | |
| D. | 该反应为吸热反应 |
18.下列各组气体,常温下因发生非氧化还原反应而不能共存的是( )
| A. | HCl、NH3 | B. | SO2、O2 | C. | NO2、NO | D. | H2、Cl2 |
5.沪昆高铁在新化洋溪建了一个新化南站,方便了新化及周边县市人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+Al2O3,下列说法正确的是( )
| A. | Al元素被还原 | |
| B. | Al2O3是氧化产物 | |
| C. | Fe2O3既是氧化剂又是还原剂 | |
| D. | 每生成1molFe时,转移电子的物质的量为3mol |
15.下列物质中,物质的量最多的是( )
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
2.下列各组物质互为同分异构体的是( )
| A. | 苯甲醇和甲基苯苯酚 | B. | 乙醇和乙醚 | ||
| C. | 丁二烯和2-丁烯 | D. | 乙醇和乙二醇 |

 或
或 等
等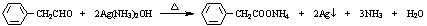 .
.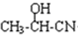 $→_{H_{2}O}^{HCI}$
$→_{H_{2}O}^{HCI}$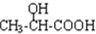 ,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色.
,现有如下转化关系:A$\stackrel{HCN}{→}$B$→_{H_{2}O}^{HCI}$C$→_{△}^{浓H_{2}SO_{4}}$D,其中D能使溴的四氯化碳溶液褪色. ;
;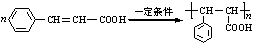 .
.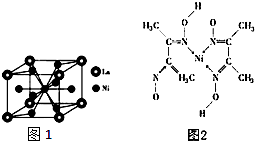 镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.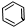 、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;