题目内容
20.从下列事实所得出的相应结论正确的是( )| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
分析 ①氢氧化钠过量,不能证明溶解度大小;
②CO2通入到Na2SiO3溶液中产生H2SiO3,反应进行属于复分解反应,符合强酸制备弱酸;
③镁、铝为电极,氢氧化钠为电解质的原电池装置中,Al为负极;
④氧化还原反应中含有元素化合价降低的物质为氧化剂,通过氧化反应得到的产物为氧化产物,根据氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性来解答;
⑤元素的最高价氧化物的水化物酸性越强,其非金属性越强.
解答 解:①氧化钠过量,不能证明溶解度大小,如加入足量氯化镁完全生成氢氧化镁沉淀后再加入氯化铁,能生成红褐色沉淀,则可证明,故①错误;
②CO2通入到Na2SiO3溶液中产生H2SiO3,实际是碳酸与碳酸钠发生反应,反应进行属于复分解反应,符合强酸制备弱酸,故②正确;
③镁、铝为电极,氢氧化钠为电解质的原电池装置中,Al为负极,Mg为正极,氢离子在Mg电极上得到电子生成氢气,但金属性Mg>Al,Mg与NaOH不反应,故③错误;
④5Cl2+I2+6H2O═2HIO3+10HCl,氧化剂为Cl2,氧化产物为IO3-,所以氧化性Cl2>IO3-;
2BrO3-+Cl2═2ClO3-+Br2,氧化剂为BrO3-,氧化产物为ClO3-,所以氧化性BrO3->ClO3-;
所以得不到氧化性BrO3->Cl2.故④错误;
⑤测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大,说明酸性:Na2SO4>Na2CO3,所以得非金属性S>C,故⑤正确;
故选B.
点评 本题考查较为综合,涉及沉淀转化、酸性、金属活动性、氧化性、非金属性比较等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握实验的角度和原理,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
10.以下实验事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
①0.1mol/L的氨水可以使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③0.1mol/L的氨水的pH值为11.2 ④铵盐受热易分解.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
5.常温下能用铁制或铝制容器盛放的是( )
| A. | 稀硝酸、稀硫酸 | B. | 硝酸银溶液 | C. | 浓硝酸、浓硫酸 | D. | 硫酸铜溶液 |
12.下列由相关实验现象所推出的结论正确的是( )
| A. | 铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 | |
| B. | 将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 | |
| C. | 将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 | |
| D. | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
20.由实验现象推出的结论正确的是( )
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
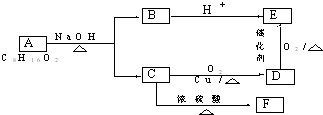
 .
.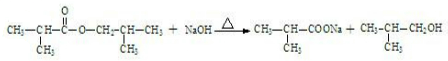 .
.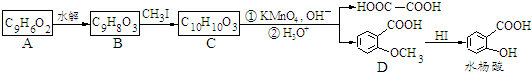
 .
.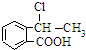 合成
合成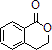 ,写出相关化学反应方程式
,写出相关化学反应方程式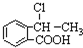 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$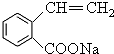 +H2O+NaCl、
+H2O+NaCl、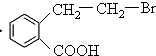 、
、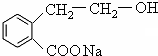 ++NaBr+H2O、2
++NaBr+H2O、2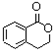 +2H2O+Na2SO4.
+2H2O+Na2SO4.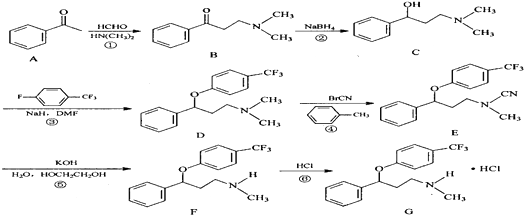
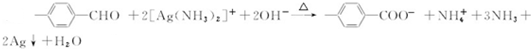
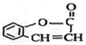
 .
.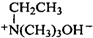 $\stackrel{△}{→}$CH2=CH2;请写出以
$\stackrel{△}{→}$CH2=CH2;请写出以 、HCHO、HN(CH3)2为有机原料,合成
、HCHO、HN(CH3)2为有机原料,合成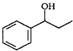 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH}$ CH3CH2OH.