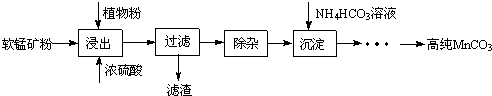
题目内容
8.香豆素是广泛存在于植物中的一类芳香族化合物,大多具有光敏性,有的还具有抗菌和消炎作用.它的核心结构是芳香内酯A,其分子式为C9H6O2.该芳香内酯A经下列步骤转变为水杨酸、乙二酸等物质.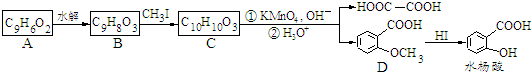
已知:①CH3CH=CHCH2CH3$→_{②H_{3}O+}^{①KMnO_{4},OH-}$CH3COOH+CH3CH2COOH
②RCH=CH$→_{过氧化物}^{HBr}$RCH2CH2Br
(1)写出化合物A的结构简式
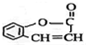 .
.(2)上述转化过程中,属于取代反应的有3个;反应步骤B→C的目的是保护酚羟基,使之不被氧化.
(3)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应.这类同分异构体(不含C-O-O-结构)共有9种.
(4)鉴别A、B、C三种物质,所需的试剂是ad(选填编号).
a.饱和FeCl3溶液,新制Cu(OH)2悬浊液 b.饱和FeCl3溶液,酸性KMnO4溶液
c.饱和FeCl3溶液,NaOH溶液 d.饱和FeCl3溶液,饱和NaHCO3溶液
(5)设计合理方案,由
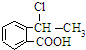 合成
合成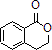 ,写出相关化学反应方程式
,写出相关化学反应方程式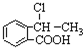 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +H2O+NaCl、
+H2O+NaCl、 +HBr$\stackrel{过氧化物}{→}$
+HBr$\stackrel{过氧化物}{→}$ 、
、 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$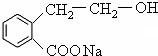 ++NaBr+H2O、2
++NaBr+H2O、2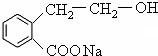 +H2SO4$\stackrel{△}{→}$2
+H2SO4$\stackrel{△}{→}$2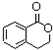 +2H2O+Na2SO4.
+2H2O+Na2SO4.
分析 C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为 ,B和CH3I发生取代反应生成C,则B的结构简式为:
,B和CH3I发生取代反应生成C,则B的结构简式为: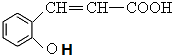 ,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为: ,D在HI条件下发生取代反应生成水杨酸.(5)中
,D在HI条件下发生取代反应生成水杨酸.(5)中 在氢氧化钠的醇溶液、加热条件下发生消去反应生成
在氢氧化钠的醇溶液、加热条件下发生消去反应生成 ,
, 与HBr发生加成反应生成
与HBr发生加成反应生成 ,
, 在氢氧化钠的水溶液、加热条件下发生取代反应生成
在氢氧化钠的水溶液、加热条件下发生取代反应生成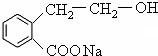 ,
,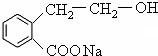 在浓硫酸加热条件下发生酯化反应生成
在浓硫酸加热条件下发生酯化反应生成 .
.
解答 解:C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为 ,B和CH3I发生取代反应生成C,则B的结构简式为:
,B和CH3I发生取代反应生成C,则B的结构简式为: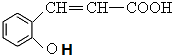 ,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
,A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为: ,D在HI条件下发生取代反应生成水杨酸,
,D在HI条件下发生取代反应生成水杨酸,
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)上述转化过程中,A→B,B→C,D→水杨酸的转化属于取代反应,C→D的转化属于氧化反应;
由于C→D转化过程发生氧化反应,可以氧化酚羟基,故反应步骤B→C的目的是:B生成C的目的是保护酚羟基,使之不被氧化,
故答案为:3;保护酚羟基,使之不被氧化;
(3)化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,说明含有两个取代基,能水解说明含有酯基,且水解后生成的产物之一能发生银镜反应,说明产物中含有醛基,应为甲酸形成的酯基,
则其同分异构体为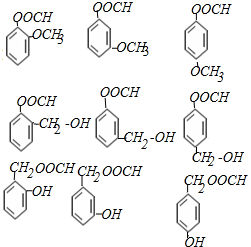 ,所以共有9种,
,所以共有9种,
故答案为:9;
(4)A含有碳碳双键与酯基,B含有碳碳双键、酚羟基、羧基,C含有碳碳双键、羧基、醚键,利用与饱和FeCl3溶液显色反应可以鉴别出B,由于水解、酯基均与氢氧化钠反应,可以用羧基与氢氧化铜、饱和碳酸氢钠溶液鉴别A与C,氢氧化铜溶解或有气体生成的为C,另外物质为A,
故答案为:ad;
(5) 在氢氧化钠的醇溶液、加热条件下发生消去反应生成
在氢氧化钠的醇溶液、加热条件下发生消去反应生成 ,
, 与HBr发生加成反应生成
与HBr发生加成反应生成 ,
, 在氢氧化钠的水溶液、加热条件下发生取代反应生成
在氢氧化钠的水溶液、加热条件下发生取代反应生成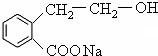 ,
,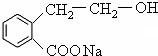 在浓硫酸加热条件下发生酯化反应生成
在浓硫酸加热条件下发生酯化反应生成 ,相关化学反应方程式为
,相关化学反应方程式为 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +H2O+NaCl、
+H2O+NaCl、 +HBr$\stackrel{过氧化物}{→}$
+HBr$\stackrel{过氧化物}{→}$ 、
、 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$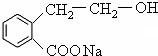 ++NaBr+H2O、2
++NaBr+H2O、2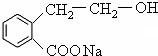 +H2SO4$\stackrel{△}{→}$2
+H2SO4$\stackrel{△}{→}$2 +2H2O+Na2SO4,
+2H2O+Na2SO4,
故答案为: +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +H2O+NaCl、
+H2O+NaCl、 +HBr$\stackrel{过氧化物}{→}$
+HBr$\stackrel{过氧化物}{→}$ 、
、 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$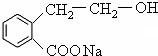 ++NaBr+H2O、2
++NaBr+H2O、2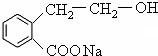 +H2SO4$\stackrel{△}{→}$2
+H2SO4$\stackrel{△}{→}$2 +2H2O+Na2SO4.
+2H2O+Na2SO4.
点评 本题考查有机物推断与合成,注意根据有机物的结构进行推断,需要学生熟练掌握官能团的性质与转化,难点是推断D的同分异构体,难度中等.

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案| A. | 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 OH-+SO2═HSO3- | |
| D. | 硝酸铁溶液加入过量氨水 3NH3•H2O+Fe3+═Fe(OH)3↓+3 NH4+ |
| A. | Na2O2 | B. | Al(OH)3 | C. | H2SO4 | D. | BaSO4 |
| A. | 分子中各原子最外层都满足8电子稳定结构 | |
| B. | 键角均为60°,都是含有极性键的极性分子 | |
| C. | BF3沸点低于BCl3沸点,因为B-F键键长短 | |
| D. | BF3分子稳定性高于BCl3,因为B-F键键能高 |
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki=1.7×10-5 |
| HClO | Ki=3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、ClO- | B. | HClO、HCO3-、CH3COO-、ClO- | ||
| C. | HClO、HCO3-、ClO-、CO32- | D. | HCO3-、CH3COO-、ClO-、CO32- |
| A. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| B. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基 | |
| C. | 向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI | |
| D. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
| A. |  如图表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. |  如图表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 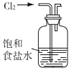 用如图所示装置吸收氯气中的氯化氢气体 | |
| D. | 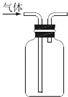 用图所示装置收集一氧化氮气体 |