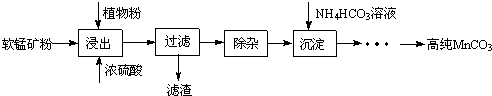
题目内容
9.写出下列反应的离子方程式:硫酸铜和氢氧化钙溶液:SO42-+Ca2++Cu2++2OH-=Cu(OH)2↓+CaSO4↓
氯化镁和氢氧化钾溶液:Mg2++2OH-=Mg(OH)2↓
氯化钡和硫酸钠溶液:SO42-+Ba2+=BaSO4↓
硫酸氢钠和氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O或Ba2++OH-+H++SO42-=BaSO4↓+H2O
铁和硫酸铜溶液:Fe+Cu2+=Cu+Fe2+.
分析 硫酸铜与氢氧化钙反应生成氢氧化铁和硫酸钙沉淀;
氯化镁与氢氧化钾反应生成氢氧化镁沉淀和氯化钾;
氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠;
硫酸氢钠与氢氧化钡溶液反应生成硫酸钡沉淀和水,根据氢氧化钡过量与不足分别写出反应的离子方程式;
铁与硫酸铜溶液反应生成硫酸亚铁和铜单质,据此写出反应的离子方程式.
解答 解:硫酸铜和氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,反应的离子方程式为:SO42-+Ca2++Cu2++2OH-=Cu(OH)2↓+CaSO4↓,
故答案为:SO42-+Ca2++Cu2++2OH-=Cu(OH)2↓+CaSO4↓;
氯化镁和氢氧化钾溶液反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;
氯化钡与硫酸钠溶液反应生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,
故答案为:SO42-+Ba2+=BaSO4↓;
硫酸氢钠与氢氧化钡反应生成硫酸钡和水,当反应后溶液为中性时,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
若氢氧化钡足量时,离子方程式按照硫酸氢钠的化学式书写,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O或Ba2++OH-+H++SO42-=BaSO4↓+H2O;
铁与硫酸铜溶液反应化学方程式为Fe+CuSO4=Cu+FeSO4,硫酸亚铁和硫酸铜都是易溶于水的盐,反应离子方程式为Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+Cu2+=Cu+Fe2+.
点评 本题考查离子反应方程式的书写,题目难度中等,明确物质的性质及发生的化学反应是解答的关键,注意掌握离子方程式的书写原则,试题培养了学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na2O2 | B. | Al(OH)3 | C. | H2SO4 | D. | BaSO4 |
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
| A. |  如图表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. |  如图表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 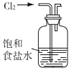 用如图所示装置吸收氯气中的氯化氢气体 | |
| D. | 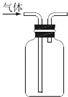 用图所示装置收集一氧化氮气体 |
| A. | 尽可能减少食品的加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用作物秸秆为燃料 |
| 实验编号 | HA | NaOH | 混合后溶液的pH |
| 甲 | C(HA)=0.2mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=a |
| 乙 | C(HA)=c1mol•L-1 | C(NaOH)=0.2mol•L-1 | pH=7 |
| 丙 | C(HA)=0.1mol•L-1 | C(NaOH)=0.1mol•L-1 | pH=9 |
| 丁 | pH=2 | pH=12 | pH=b |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸?若a=7,则HA是强酸;若a>7,则HA是弱酸.
(2)若考虑其他组的实验结果,则c1>(填“<”、“>”或“=”)0.2mol•L-1;乙组实验中HA和NaOH溶液混合前,HA溶液中C(A-)与NaOH溶液中C(Na+)的关系是B
A.前者大 B.后者大 C.二者相等 D.无法判断.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+);其中,C(A-)=0.1+1×10-9-1×10-5mol•L-1(不能做近似计算,回答准确值,结果不一定要化简).
(4)丁组实验中,HA和NaOH溶液混合前后C(HA)>(填“<”、“>”或“=”)C(NaOH);b<7(填“<”、“>”或“=”)
| A. | KHCO3+HCl═KCl+CO2↑+H2O | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | NaCO3+Ca(OH)2═CaCO3↓+2NaOH | D. | 2HCl+NaSO4═2NaCl+H2SO4 |