题目内容
12.下列由相关实验现象所推出的结论正确的是( )| A. | 铁在常温下不溶于浓硝酸,说明铁与浓硝酸不反应 | |
| B. | 将氯气溶于水后溶液呈浅黄绿色,说明氯气与水没有完全反应 | |
| C. | 将某气体通入品红溶液中溶液褪色,说明该气体一定是二氧化硫 | |
| D. | 向溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
分析 A.常温下,铁与浓硝酸发生钝化反应;
B.氯气溶于水,溶液颜色为氯气的颜色;
C.能使品红褪色的不一定为二氧化硫;
D.不能排出生成AgCl沉淀.
解答 解:A.常温下,铁与浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜而阻碍反应的继续进行,故A错误;
B.氯气溶于水,溶液颜色为氯气的颜色,故B正确;
C.能使品红褪色的不一定为二氧化硫,可能为二氧化氮、臭氧等,故C错误;
D.不能排出生成AgCl沉淀,应先加入盐酸,如无现象,再加入氯化钡检验,故D错误.
故选B.
点评 本题考查较为综合,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
2.下列关于炔烃的说法中正确的是( )
| A. | 含有叁键的有机物是炔烃 | |
| B. | 能使溴水褪色的物质是烯烃或炔烃 | |
| C. | 乙炔分子中所有原子都在同一直线上 | |
| D. | 分子式为C5H8的链烃一定是炔烃 |
3.根据右表提供的数据可知能大量共存的微粒组是( )
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ki=1.7×10-5 |
| HClO | Ki=3.0×10-8 |
| H2CO3 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、ClO- | B. | HClO、HCO3-、CH3COO-、ClO- | ||
| C. | HClO、HCO3-、ClO-、CO32- | D. | HCO3-、CH3COO-、ClO-、CO32- |
20.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
7.某溶液中含HCO3-,SO32-,CO32-,CH3COO-四种阴离子,向其中加入足量的Na2O2固体后,上列四种阴离子的浓度变化最小的是( )
| A. | HCO3- | B. | SO32- | C. | CO32- | D. | CH3COO- |
17.下列实验操作或装置(略去部分加持仪器)正确的是( )
| A. |  如图表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. |  如图表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 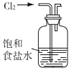 用如图所示装置吸收氯气中的氯化氢气体 | |
| D. | 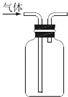 用图所示装置收集一氧化氮气体 |
4.下列做法不能体现低碳生活的是( )
| A. | 尽可能减少食品的加工过程 | B. | 注意节约用电 | ||
| C. | 尽量购买本地的、当季的食物 | D. | 大量使用作物秸秆为燃料 |
1.下列反应不能发生的是( )
| A. | KHCO3+HCl═KCl+CO2↑+H2O | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | NaCO3+Ca(OH)2═CaCO3↓+2NaOH | D. | 2HCl+NaSO4═2NaCl+H2SO4 |
12.下列两组命题中,N组命题正确,且能用M组命题加以解释的是( )
| M组 | N组 | |
| A | H-I键键能大于H-Cl键键能 | HI比HCl稳定 |
| B | HI分子间作用力小于HCl分子间作用力 | HCl比HI稳定 |
| C | HI分子间作用力大于HCl分子间作用力 | HI的沸点比HCl高 |
| D | H-I键键能小于H-Cl键键能 | HI的沸点比HCl高 |
| A. | A | B. | B | C. | C | D. | D |