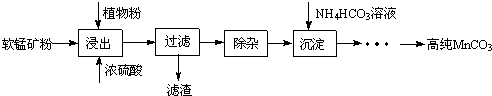
题目内容
20.由实验现象推出的结论正确的是( )| 选项 | 实验方案 | 现象 | 结论 |
| A | 将水垢置于盛食醋的试管中 | 有气泡产生 | 醋酸的酸性比碳酸强 |
| B | 用湿润的蓝色试纸检验某气体 | 试纸变红 | 气体是酸性氧化物 |
| C | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | NaHCO3不溶于水 |
| D | 向酚酞溶液中加少量Na2O2 | 溶液变红 | Na2O2是碱性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、水垢的主要成份是碳酸钙,加食醋有气泡,说明生成二氧化碳,强酸制弱酸;
B、用湿润的蓝色试纸检验某气体,试纸变红,该气体是酸性气体,如氯化氢;
C、NaHCO3不是不溶于水,而是溶解度小;
D、向酚酞溶液中加少量Na2O2,溶液变红,说明过氧化钠溶于水溶液呈碱性,但过氧化钠不是碱性氧化物.
解答 解:A、水垢的主要成份是碳酸钙,加食醋有气泡,说明生成二氧化碳,强酸制弱酸,所以醋酸的酸性比碳酸强,故A正确;
B、用湿润的蓝色试纸检验某气体,试纸变红,该气体是酸性气体,如氯化氢,不是氧化物,而是氢化物,故B错误;
C、NaHCO3不是不溶于水,而是溶解度小,故C错误;
D、向酚酞溶液中加少量Na2O2,溶液变红,说明过氧化钠溶于水溶液呈碱性,但过氧化钠不是碱性氧化物,是过氧化物,故D错误;
故选A.
点评 本题考查化学实验方案的评价,把握物质的性质及检验方法为解答的关键,选项B为解答的易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在镁铝为电极,氢氧化钠为电解质的原电池装置中,镁表面有气泡 | 金属活动性:Al>Mg |
| ④ | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl, 2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>ClO3->IO3- |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |
1.下列反应不能发生的是( )
| A. | KHCO3+HCl═KCl+CO2↑+H2O | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | NaCO3+Ca(OH)2═CaCO3↓+2NaOH | D. | 2HCl+NaSO4═2NaCl+H2SO4 |
15.下列有关化学用语表示正确的是( )
| A. | H2F+的电子式: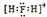 | |
| B. | 铝原子的结构示意图: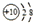 | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | K2CO3水解的离子方程式:CO32-+2H2O?H2CO3+2OH- |
5.下列各组离子在溶液中能大量共存的是( )
| A. | Ca2+、K+、NO3-、Cl- | B. | Na+、Ba2+、Br-、SO32- | ||
| C. | H+、Na+、SiO32-、Cl- | D. | H+、Fe3+、I-、NO3- |
12.下列两组命题中,N组命题正确,且能用M组命题加以解释的是( )
| M组 | N组 | |
| A | H-I键键能大于H-Cl键键能 | HI比HCl稳定 |
| B | HI分子间作用力小于HCl分子间作用力 | HCl比HI稳定 |
| C | HI分子间作用力大于HCl分子间作用力 | HI的沸点比HCl高 |
| D | H-I键键能小于H-Cl键键能 | HI的沸点比HCl高 |
| A. | A | B. | B | C. | C | D. | D |