题目内容
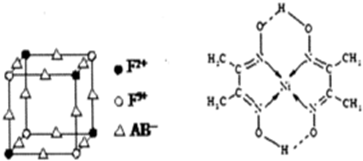
3.下列实验装置或操作设计正确且能达到实验目的是( )| A. |  称量NaOH固体 | B. |  配制一定物质的量浓度稀硫酸 | ||
| C. |  制取少量的Fe(OH)3胶体 | D. |  用H2SO4标准溶液滴定NaOH溶液 |
分析 A.称量固体质量时左物右码,且NaOH应在小烧杯中;
B.不能将浓硫酸直接注入容量瓶中;
C.胶体不能透过半透明,而离子可以;
D.H2SO4标准溶液滴定NaOH溶液,左手控制活塞,右手振荡锥形瓶,但不能判断滴定终点.
解答 解:A.称量固体质量时左物右码,且NaOH应在小烧杯中,图中NaOH应放在小烧杯且在左边,操作不合理,故A错误;
B.不能将浓硫酸直接注入容量瓶中,应将浓硫酸在烧杯中稀释、冷却后转移到容量瓶中定容,故B错误;
C.胶体不能透过半透明,而离子可以,则图中渗析操作合理,故C正确;
D.H2SO4标准溶液滴定NaOH溶液,左手控制活塞,右手振荡锥形瓶,但图中没有指示剂无法判断滴定终点,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及固体称量、溶液配制、混合物分离提纯、中和滴定等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
7.工业上氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+O2(g) ?催化剂高温高压2SO3(g)△H=-198kJ•mol-1在一定条件下,将SO2和O2在体积不变的密闭容器中反应达到平衡状态,下列措施会使化学平衡向逆反应方向移动的是( )
| A. | 增加二氧化硫 | B. | 升高温度 | C. | 降低温度 | D. | 移出三氧化硫 |
8.下列性质对应于晶体类型的说法较为合理的是( )
①熔点1070℃,易溶于水,水溶液导电
②熔点10.34℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6℃
④熔点97.81℃,质软导电,密度为0.97g•cm-3.
①熔点1070℃,易溶于水,水溶液导电
②熔点10.34℃,液态不导电,水溶液导电
③能溶于CS2,熔点112.8℃,沸点444.6℃
④熔点97.81℃,质软导电,密度为0.97g•cm-3.
| A. | ①离子晶体②分子晶体③分子晶体④金属晶体 | |
| B. | ①原子晶体②分子晶体③分子晶体④金属晶体 | |
| C. | ①离子晶体②分子晶体③金属晶体④金属晶体 | |
| D. | ①原子晶体②离子晶体③分子晶体④分子晶体 |
11.某酸性溶液中含有NH4+、Cl-、H+、OH-四种离子,下列叙述正确的是( )
| A. | 该溶液可能由pH=3盐酸与pH=11的NH3•H2O溶液等体积混合而成 | |
| B. | 该溶液可能由等物质的量浓度的NH3•H2O与盐酸以2:1的体积比混合 | |
| C. | 该溶液中由水电离出的氢离子浓度一定大于1.0×10-7mol•L-1 | |
| D. | 加入一定量NH3•H2O,c(NH4+)可能大于、等于或小于c(Cl-) |
15.化学与生化、社会密切相关,下列说法不正确的是( )
| A. | 维生素在天然食品中含量丰富,所以加工后的食品中维生素的含量也高 | |
| B. | 2M+N=2P+2Q,2P+M=Q(M、N为原料,Q为期望产品)符合“化学反应的绿色化”的要求 | |
| C. | 稀的双氧水可用于清洗伤口,以达到杀菌、消毒的目的 | |
| D. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
12.下列有关化学用语表示正确的是( )
| A. | 氟原子的结构示意图: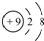 | |
| B. | 邻硝基甲苯的结构简式: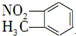 | |
| C. | 质子数为27、中子数为33的Co原子:6027Co | |
| D. | H2O2的电子式: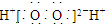 |
13.下列说法正确的是( )
| A. | 蛋白质在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 汽油、甘油、花生油都属于酯类物质 | |
| C. | 麦芽糖及其水解产物均能发生银镜反应 | |
| D. | 燃煤产生的二氧化硫是引起雾霾的主要原因 |
 ;
;