题目内容
7.工业上氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+O2(g) $?_{高温高压}^{催化剂}$2SO3(g)△H=-198kJ•mol-1在一定条件下,将SO2和O2在体积不变的密闭容器中反应达到平衡状态,下列措施会使化学平衡向逆反应方向移动的是( )| A. | 增加二氧化硫 | B. | 升高温度 | C. | 降低温度 | D. | 移出三氧化硫 |
分析 将SO2和O2在体积不变的密闭容器中反应达到平衡状态,改变条件使化学平衡向逆反应方向移动的条件是减少反应物浓度或增大生成物浓度,反应是放热反应升高温度平衡向吸热反应方向进行,反应前后气体体积减小的反应,减小压强平衡向气体体积增大的方向.
解答 解:2SO2(g)+O2(g) $?_{高温高压}^{催化剂}$2SO3(g)△H=-198kJ•mol-1,反应是气体体积减小的放热反应,
A、增加二氧化硫,反应物浓度增大,平衡正向进行,故A错误;
B、反应是放热反应,升温平衡逆向进行,故B正确;
C、反应是放热反应,降低温度平衡正向进行,故C错误;
D、移出三氧化硫,减少生成物浓度,平衡正向进行,故D错误;
故选:B.
点评 本题考查了化学平衡影响因素的分析判断,反应特征和平衡移动原理的理解应用是解题的关键,题目较简单.

练习册系列答案
相关题目
17.下列有关化学用语正确的是( )
| A. | Cl-离子的结构示意图: | B. | 甲烷的结构式为: | ||
| C. | 丙烷分子的比例模型示意图: | D. | 乙醇的分子式:CH3CH2OH |
15.下列各物质中属于纯净物的是( )
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯⑧纯净的盐酸.
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯⑧纯净的盐酸.
| A. | ⑤⑦ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ①④ |
2.有下列两组命题
B组中命题正确,且能用A组命题加以正确解释的是( )
| A组 | B组 |
| Ⅰ.H-F键键能小于H-Cl键键能 | ①HCl比HF稳定 |
| Ⅱ.H-I键键能小于H-Cl键键能 | ②HCl比HI稳定 |
| Ⅲ.HCl分子间作用力大于HF分子间作用力 | ③HCl沸点比HF高 |
| Ⅳ.HI分子间作用力小于HCl分子间作用力 | ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
12.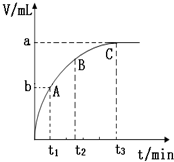 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.
Ⅰ.下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
请你分析回答:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)该研究小组在设计方案时,考虑了浓度、温度、催化剂等反应条件对过氧化氢分解速率的影响.
(3)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?温度升高化学反应速率加快(或反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快).
(4)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
(5)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,反应的离子方程式为MnO2+2H++H2O2=Mn2++O2↑+2H2O.
Ⅱ.现提供下列实验用品研究化学反应速率的影响因素.
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸
①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,
为了便于观察,你建议记录的数据是反应开始到停止所用的时间.
②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.
 某同学在实验室进行实验研究化学反应速率的影响因素.
某同学在实验室进行实验研究化学反应速率的影响因素.Ⅰ.下表是研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2溶液制取150mL氧气所需的时间(单位:s)
浓 度 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加 热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)该研究小组在设计方案时,考虑了浓度、温度、催化剂等反应条件对过氧化氢分解速率的影响.
(3)从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?温度升高化学反应速率加快(或反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快).
(4)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
(5)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,反应的离子方程式为MnO2+2H++H2O2=Mn2++O2↑+2H2O.
Ⅱ.现提供下列实验用品研究化学反应速率的影响因素.
实验仪器:试管、烧杯、量筒、天平、秒表
实验药品:铝片、铝粉、0.5mol/L 盐酸、5mol/L 盐酸
①利用所提供实验用品,可研究的化学反应速率的影响因素是盐酸的浓度、铝的表面积,
为了便于观察,你建议记录的数据是反应开始到停止所用的时间.
②若要研究温度对化学反应速率的影响,还需用到的主要仪器是温度计.
19.下列关于Li、Na、K、Rb、Cs碱金属元素的性质比较中,与事实不完全相符合的是( )
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
16.关于元素周期表中的16号元素的说法正确的是( )
| A. | 最高正价是+5价 | B. | 最低负价为-2价 | ||
| C. | 该元素位于第二周期 | D. | 该元素属于ⅤA族元素 |
3.下列实验装置或操作设计正确且能达到实验目的是( )
| A. |  称量NaOH固体 | B. |  配制一定物质的量浓度稀硫酸 | ||
| C. |  制取少量的Fe(OH)3胶体 | D. |  用H2SO4标准溶液滴定NaOH溶液 |