题目内容
1.水是制取氢气的常见原料,下列说法正确的是( )| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
分析 A、H3O+中O原子成3个σ键,有一对未成键的孤对电子,价层电子对数为4,采取sp3型杂化杂化;
B、氢键存在于非金属性较强的非金属元素的氢化物之间;
C、在冰晶体中,每个水分子与相邻的4个水分子形成氢键,利用均摊法计算;
D、氢键是影响物质的物理性质,与化学性质无关.
解答 解:A、H3O+中O原子成3个σ键,有一对未成键的孤对电子,价层电子对数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,H3O+分子空间构型是三角锥形,故A正确;
B、冰中存在氢键,水中也存在氢键,故B错误;
C、在冰晶体中,每个水分子与相邻的4个水分子形成氢键,每1个水分子平均形成2个氢键,故C错误;
D、水分子内不含氢键,只存在与水分子之间,H2O是一种非常稳定的化合物,这是由于H-O键键能较大所致,故D错误;
故选A.
点评 本题考查氢键的形成与性质,题目难度不大,注意氢键与分子间作用力、化学键的区别,易错点为氢键对物质性质的影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | C2F4 CH3Cl | B. | CO2 C2H2 | C. | C60 S8 | D. | NH3 PH3 |
9.某基态原子的价电子排布式为4s24p1,则下列说法错误的是( )
| A. | 该元素在周期表中的位置是第4周期第ⅢA族 | |
| B. | 该元素原子核外有4个电子层 | |
| C. | 该元素原子最外层共有3个电子 | |
| D. | 该元素基态原子的电子排布式为[Ar]4s24p1 |
16.下列有关σ键、π键的说法错误的是( )
| A. | 一般碳碳σ键比π键重叠程度大,形成的共价键强 | |
| B. | 分子中含有共价键,则至少含有一个σ键 | |
| C. | 在气体单质中,一定有σ键,可能有π键 | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C-H σ键 |
6.下列叙述错误的是( )
| A. | 13C和14C互为同位素 | B. | 1H和2H是不同的核素 | ||
| C. | 6Li和7Li的电子数相等 | D. | 14C和14N属于同种元素 |
13.酸根离子RO3-所含电子比NO3-多10个,则下列说法中正确的是( )
| A. | RO3-中R元素的化合价与NO3-中的N元素的化合价相同 | |
| B. | R原子的电子层数与N原子电子层数相同 | |
| C. | RO3-中的R元素与NO3-中N元素都只能被还原,不能被氧化 | |
| D. | R元素在自然界中既以游离态又以化合态存在 |
10.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是
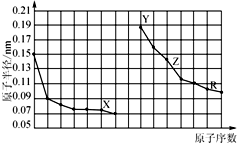

| A. | 同周期元素中,X的气态氢化物最稳定 | |
| B. | Y、Z的单质在空气中加热,均发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z. |
18.下列反应属于放热反应的是( )
| A. | 锌粒与稀H2SO4反应 | B. | NaOH溶于水 | ||
| C. | CaCO3受热分解 | D. | 氯化铵晶体与氢氧化钡晶体反应 |