题目内容
18.下列反应属于放热反应的是( )| A. | 锌粒与稀H2SO4反应 | B. | NaOH溶于水 | ||
| C. | CaCO3受热分解 | D. | 氯化铵晶体与氢氧化钡晶体反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A.锌粒与稀H2SO4反应,是金属与酸反应,属于放热反应,故A正确;
B.NaOH溶于水是放热过程,不是化学反应,故B错误;
C.碳酸钙在高温下的分解反应是吸热反应,故C错误;
D.氢氧化钡与氯化铵反应是铵盐和强碱反应,是常见吸热反应,故D错误;
故选A.
点评 本题考查放热反应,难度不大,掌握中学化学中常见的吸热或放热的反应是解题的关键.

练习册系列答案
相关题目
1.水是制取氢气的常见原料,下列说法正确的是( )
| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )
| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
6.元素砹(At)原子序数为85,下面关于该元素说法不正确的是( )
| A. | AgAt 不溶于水 | |
| B. | HAt很不稳定 | |
| C. | At的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
13.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 氢氧化钠与稀盐酸反应 | B. | 锌与稀硫酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 灼热的炭与二氧化碳反应 |
3.有100mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示,则( )

| A. | x为强酸,y为弱酸 | |
| B. | 随着稀释的进行,y的电离程度减小 | |
| C. | 稀释前x、y的物质的量浓度相等 | |
| D. | 稀释后的x、y分别分别与足量的锌反应,y放出的氢气多 |
10.下列关于营养物质的说法正确的是( )
| A. | 油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物 | |
| B. | 油脂经皂化反应后,可用饱和食盐水使硬脂酸钠析出 | |
| C. | 2mol蔗糖的水解产物是1mol葡萄糖和1mol果糖 | |
| D. | 淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜 |
7.下列有关化学用语正确的是( )
| A. | 氯化氢分子的电子式: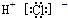 | |
| B. | H2O的结构式:H-O-H | |
| C. | 硫原子的结构示意图: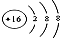 | |
| D. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O |
8.下列说法或计算正确的是( )
| A. | 采用加热蒸发溶剂的方法可以使浓度为4 mol/L的盐酸溶液的浓度变为8 mol/L | |
| B. | 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% | |
| C. | 将2.3 g Na投入到97.7g水中充分反应,所得溶液的质量分数为4.0% | |
| D. | 已知某温度下KNO3的溶解度是31.6 g,该温度下将20 g KNO3溶解于50 g水中,充分溶解,获得溶液的质量分数是28.6% |