题目内容
13.酸根离子RO3-所含电子比NO3-多10个,则下列说法中正确的是( )| A. | RO3-中R元素的化合价与NO3-中的N元素的化合价相同 | |
| B. | R原子的电子层数与N原子电子层数相同 | |
| C. | RO3-中的R元素与NO3-中N元素都只能被还原,不能被氧化 | |
| D. | R元素在自然界中既以游离态又以化合态存在 |
分析 酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,则R比N原子多10个电子,R的原子序数为17,应为Cl元素,结合元素对应单质、化合物的性质解答该题.
解答 解:酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,则R比N原子多10个电子,R的原子序数为17,应为Cl元素.
A.RO3-中R的化合价与NO3-中N化合价相等,都是+5价,故A正确;
B.Cl原子有3个电子层、N原子有2个电子层,Cl原子的电子层数比N的电子层数多1,故B错误;
C.ClO3-中Cl元素化合价处于中间价态,既有氧化性又有还原性,故C错误;
D.Cl元素很活泼,在自然界中以化合态形式存在,故D错误;
故选A.
点评 本题考查元素位置结构性质的相互关系,题目难度不大,C中注意根据化合价判断ClO3-的性质,有利于基础知识的巩固.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案
相关题目
3.仅用下表提供的仪器和用品能够实现相应目的是( )
| 选项 | 实验目的 | 仪器和用品 |
| A | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 检验溶液中是否含有SO42- | 试管、胶头滴管、Ba(NO3)2 |
| C | SO2既有氧化性,又有还原性 | 试管、胶头滴管、氯水、品红 |
| D | 配制100mLpH=2的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管、酸式滴定管、pH=1的盐酸 |
| A. | A | B. | B | C. | C | D. | D |
1.水是制取氢气的常见原料,下列说法正确的是( )
| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
8.用以下方法制取氢气,反应速率最小的是( )
| A. | 冬天,块状的锌与2mol/L稀硫酸溶液反应 | |
| B. | 冬天,粉末状的锌与2mol/L稀硫酸溶液反应 | |
| C. | 夏天,块状的锌与2mol/L稀硫酸溶液反应 | |
| D. | 夏天,粉末状的锌与2mol/L稀硫酸溶液反应 |
18. A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )
| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
10.下列关于营养物质的说法正确的是( )
| A. | 油脂的氢化属于还原反应,又属于加成反应,生成物为纯净物 | |
| B. | 油脂经皂化反应后,可用饱和食盐水使硬脂酸钠析出 | |
| C. | 2mol蔗糖的水解产物是1mol葡萄糖和1mol果糖 | |
| D. | 淀粉溶液和稀硫酸共热后发生水解反应,冷却后加少量银氨溶液,水浴加热后会出现光亮的银镜 |
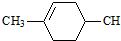 ═CHCOOCH2CH=CHCH2OOCH═
═CHCOOCH2CH=CHCH2OOCH═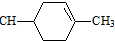
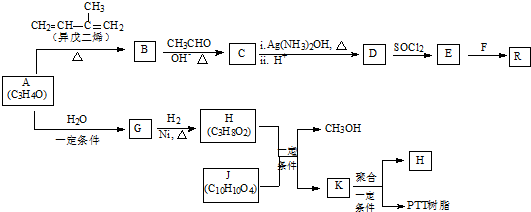
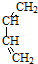 +
+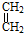 →
→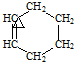
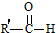 +
+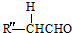 $→_{△}^{OH-}$R′CH
$→_{△}^{OH-}$R′CH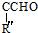 +H2O
+H2O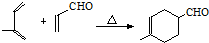 .
.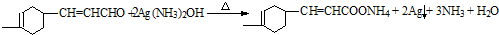 .
.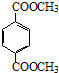 .
.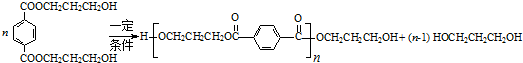 .
.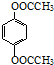 (邻、间、对三种中的任一种).
(邻、间、对三种中的任一种).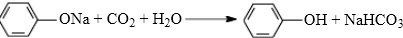 .
.