题目内容
11.下列各组分子中,都属于含极性键的非极性分子的是( )| A. | C2F4 CH3Cl | B. | CO2 C2H2 | C. | C60 S8 | D. | NH3 PH3 |
分析 非极性键为:同种元素的原子间形成的共价键;极性键为:不同元素的原子间形成的共价键;
极性分子为:正电荷中心和负电荷中心不相重合的分子;非极性分子:正电荷中心和负电荷中心相重合的分子;分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
解答 解:A、C2F4为极性键形成的非极性分子,CH3Cl为极性键形成的极性分子,故A错误;
B、CO2、C2H2中化学键都是不同元素构成的,属于极性键;二者分子中正电荷中心和负电荷中心相重合,属于非极性分子,故B正确;
C、C60 S8中只含有非极性键,为非极性分子,故C错误;
D、NH3 和PH3都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子,故D错误;
故选B.
点评 本题考查了键的极性和分子的极性判断,题目难度不大,侧重于对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.有一系列芳香族化合物,其中并四苯的一氯代物有( )
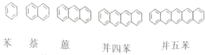

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.关于乙烯分子中的共价键,下列描述正确的是( )
| A. | 含有5个σ键、1个π键 | |
| B. | C-H之间是碳的sp2杂化轨道与H的s轨道形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 | |
| C. | 只有sp2杂化轨道才形成π键 | |
| D. | C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形的σ键 |
3.仅用下表提供的仪器和用品能够实现相应目的是( )
| 选项 | 实验目的 | 仪器和用品 |
| A | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯、玻璃棒 |
| B | 检验溶液中是否含有SO42- | 试管、胶头滴管、Ba(NO3)2 |
| C | SO2既有氧化性,又有还原性 | 试管、胶头滴管、氯水、品红 |
| D | 配制100mLpH=2的盐酸 | 100mL容量瓶、烧杯、玻璃棒、胶头滴管、酸式滴定管、pH=1的盐酸 |
| A. | A | B. | B | C. | C | D. | D |
1.水是制取氢气的常见原料,下列说法正确的是( )
| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
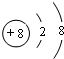 ,D元素在周期表中的位置是第三周期ⅥA族.
,D元素在周期表中的位置是第三周期ⅥA族.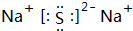 ,氢化物的稳定性是A>D(填“>”或“<”).
,氢化物的稳定性是A>D(填“>”或“<”).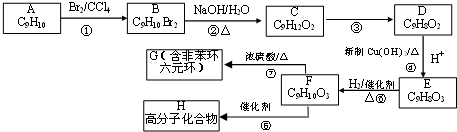
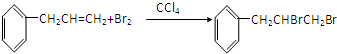 ,加成反应;
,加成反应;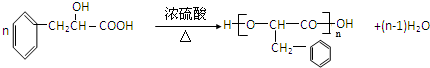 ,缩聚反应;
,缩聚反应;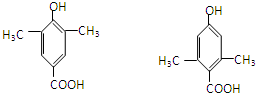 任意一种;
任意一种;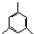 的合成路线(合成路线常用的表示方法示例如下).
的合成路线(合成路线常用的表示方法示例如下).
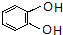 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).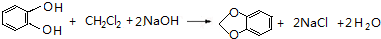 (或
(或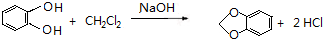 ).
).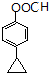 或
或 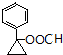 (任写一种).
(任写一种).