题目内容
9.某基态原子的价电子排布式为4s24p1,则下列说法错误的是( )| A. | 该元素在周期表中的位置是第4周期第ⅢA族 | |
| B. | 该元素原子核外有4个电子层 | |
| C. | 该元素原子最外层共有3个电子 | |
| D. | 该元素基态原子的电子排布式为[Ar]4s24p1 |
分析 若某基态原子的价电子排布式为4s24p1,该元素原子序数=2+8+18+3=31,为Ga元素,位于第四周期第ⅢA族,元素周期数与其原子电子层数相等,最外层与其族序数相等,据此分析解答.
解答 解:某基态原子的价电子排布式为4s24p1,该元素原子序数=2+8+18+3=31,为Ga元素,位于第四周期第ⅢA族,元素周期数与其原子电子层数相等,最外层与其族序数相等,
A.原子核外电子层数与其周期数相等,最外层与其族序数相等,所以该元素位于第四周期第ⅢA族,故A正确;
B.根据元素周期数与其原子电子层数相等,该元素原子有4个电子层,故B正确;
C.根据最外层与其族序数相等,最外层有3个电子,故C正确;
D.根据该元素原子序数=2+8+18+3=31,为Ga元素,基态原子的电子排布式为[Ar]3d104s24p1,故D错误;
故选D.
点评 本题考查原子核外电子排布,题目难度不大,本题注意元素价层电子排布特点以及与在周期表位置的关系,熟练掌握元素周期表的结构.

练习册系列答案
相关题目
17.下列各组反应(表中物质均为反应物)起始时,产生H2的速率最大的是( )
| 编号 | 金属(粉末) | 物质的量(mol) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Mg | 0.1 | 6mol/L HNO3 | 10mL | 60℃ |
| B | Mg | 0.1 | 1.5mol/L HCl | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| D | Mg | 0.1 | 3mol/L HCl | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
14.HBr气体的热分解温度比HI热分解温度高的原因是( )
| A. | HBr分子中的键长比HI分子中的键长短,键能大 | |
| B. | HBr分子中的键长比HI分子中的键长长,键能小 | |
| C. | HBr的相对分子质量比HI的相对分子质量小 | |
| D. | HBr分子间作用力比HI分子间作用力大 |
1.水是制取氢气的常见原料,下列说法正确的是( )
| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
18.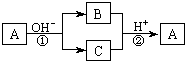 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
6.元素砹(At)原子序数为85,下面关于该元素说法不正确的是( )
| A. | AgAt 不溶于水 | |
| B. | HAt很不稳定 | |
| C. | At的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
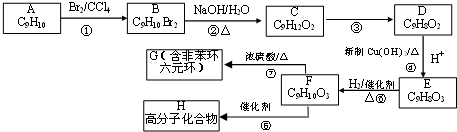
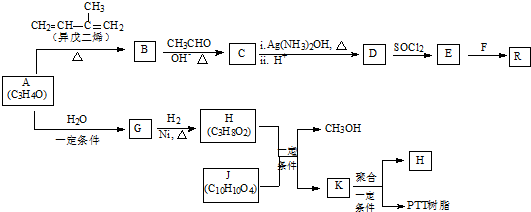
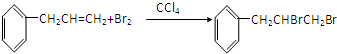 ,加成反应;
,加成反应;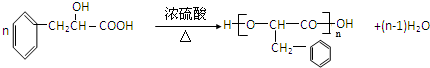 ,缩聚反应;
,缩聚反应;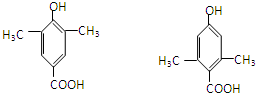 任意一种;
任意一种;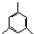 的合成路线(合成路线常用的表示方法示例如下).
的合成路线(合成路线常用的表示方法示例如下).
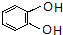 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).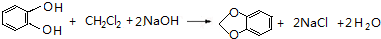 (或
(或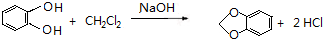 ).
).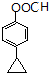 或
或 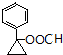 (任写一种).
(任写一种).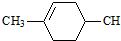 ═CHCOOCH2CH=CHCH2OOCH═
═CHCOOCH2CH=CHCH2OOCH═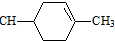
 +
+ →
→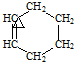
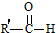 +
+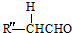 $→_{△}^{OH-}$R′CH
$→_{△}^{OH-}$R′CH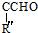 +H2O
+H2O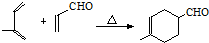 .
.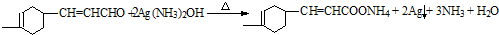 .
.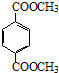 .
.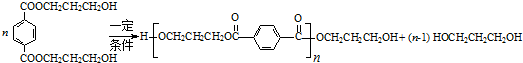 .
.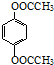 (邻、间、对三种中的任一种).
(邻、间、对三种中的任一种).