题目内容
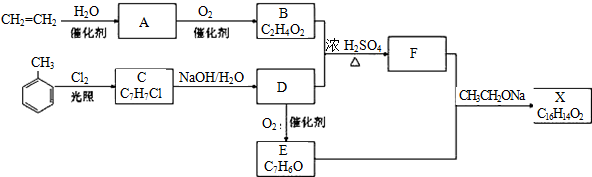
15.已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图1所示.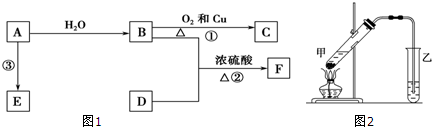
(1)A的结构式为
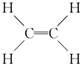 ,B中决定性质的重要官能团的名称为羟基.
,B中决定性质的重要官能团的名称为羟基.(2)写出反应的化学方程式并判断反应类型.
①2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,反应类型:氧化反应.②CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.
(3)实验室怎样鉴别B和D?取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇.
(4)在实验室里我们可以用如图2所示的装置来制取F,该装置图中有一个明显的错误是导气管的出口伸入到了液面以下.
分析 A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是饮食中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为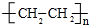 ,据此解答.
,据此解答.
解答 解:A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是饮食中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为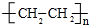 .
.
(1)A是CH2=CH2,结构式为 ,B为CH3CH2OH,决定性质的重要官能团的名称为:羟基,
,B为CH3CH2OH,决定性质的重要官能团的名称为:羟基,
故答案为: ;羟基;
;羟基;
(2)反应①的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应;
反应②的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应或取代反应;
(3)鉴别乙醇与乙酸的方法为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇,
故答案为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇;
(4)图中导气管的出口伸入到了液面以下,会导致倒吸,
故答案为:导气管的出口伸入到了液面以下.
点评 本题考查无机物推断、乙酸乙酯之比,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 质量守恒、电子守恒、电荷守恒 | B. | 电子守恒、质量守恒、电荷守恒 | ||
| C. | 电子守恒、电荷守恒、质量守恒 | D. | 电荷守恒、质量守恒、电子守恒 |
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
| A. | 冶炼镁的最后一步反应为电解MgCl2溶液 | |
| B. | 由氯化镁的结晶水合物得到氯化镁属于物理变化 | |
| C. | 利用海水和石灰水作用可以得到氯化镁 | |
| D. | 利用氯化镁冶炼金属镁而不利用氧化镁的原因是氧化镁的熔点太高 |
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
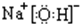
 .
. .
. CH2OCH2CH2CHO
CH2OCH2CH2CHO CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3.
COOCH2CH2CH3.