题目内容
5.常温下,下列溶液中微粒浓度关系一定正确的是( )| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
分析 A.混合液的pH=7,则c(OH-)=c(H+),根据电荷守恒判断c(Cl-)、c(NH4+)的关系;
B.若一元酸为强酸,两溶液混合后溶液显示中性,若一元酸为弱酸,则混合液中酸过量,溶液显示酸性;
C.铵根离子部分水解,溶液显示酸性,c(H+)>c(OH-);由于铵根离子水解程度较小,则c(NH4+)>c(SO42-);
D.根据硫化钠溶液中的质子守恒判断.
解答 解:A.氨水与氯化铵的pH=7的混合溶液中,溶液显示中性,则:c(OH-)=c(H+),根据电荷守恒c(Cl-)+c(OH-)=c(H+)+c(NH4+)可知,c(Cl-)=c(NH4+),故A错误;
B.pH=2的一元酸,如果为强酸,则该一元酸的浓度与一元强碱的浓度相等,混合液显示中性;若一元酸为弱酸,一元酸浓度大于0.01mol/L,混合液中一元酸过量,溶液显示酸性,所以混合液中:c(OH-)≤c(H+),故B错误;
C.0.1mol•L-1的硫酸铵溶液中,铵根离子部分水解,溶液显示酸性,则:c(H+)>c(OH-),由于铵根离子水解程度较小,则c(NH4+)>c(SO42-),溶液中离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故C正确;
D.根据质子守恒,水电离的c(OH-)=c(H+),而H+离子与S2-离子结合分别生成HS-、H2S,则有:c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,注意明确电荷守恒、物料守恒、盐的水解等知识在比较溶液中离子浓度大小中的应用方法.

练习册系列答案
相关题目
16.完全燃烧物质的量相等的某有机物和乙醇,实验测得:
①乙醇燃烧生成的CO2的量是该有机物燃烧生成的CO2的量的$\frac{2}{3}$;
②该有机物燃烧生成水的量是乙醇燃烧生成水的量的$\frac{2}{3}$;
③二者消耗相同状态下氧气的体积相同,通过分析判断该有机物是( )
①乙醇燃烧生成的CO2的量是该有机物燃烧生成的CO2的量的$\frac{2}{3}$;
②该有机物燃烧生成水的量是乙醇燃烧生成水的量的$\frac{2}{3}$;
③二者消耗相同状态下氧气的体积相同,通过分析判断该有机物是( )
| A. | C4H9OH | B. | CH2=CHCOOH | C. | CH2=CHCHO | D. | CH3CH2COOH |
13.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液:K-、Na+、Cu2+、OH- | |
| B. | 由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br+- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
20.下列各组离子,在溶液中能大量共存的是( )
| A. | NO3-、Fe2+、Cl-、H+ | B. | Na+、OH-、NH4+、AlO2- | ||
| C. | Fe3+、NO3-、S2-、OH- | D. | K+、OH-、Na+、S2- |
10.某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各离子浓度的关系错误的是( )
| A. | c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | B. | c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | c (Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | D. | c(Na+)=c(HA-)+c(HA)+2c(A2-) |
17.下列有关表示方法中,正确的是( )
| A. | 次氯酸的电子式为: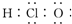 | |
| B. | 氮原子轨道表示式为: | |
| C. | 硫原子的最外层电子排布式为:3s23p4 | |
| D. | N2的结构式为::N≡N: |
14.下列不属于烃类物质的是( )
| A. | C6H6 | B. | C2H4 | C. | C2H5OH | D. | C3H4 |
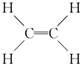 ,B中决定性质的重要官能团的名称为羟基.
,B中决定性质的重要官能团的名称为羟基.