题目内容
11.实验室里用某工厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4•7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:
(1)若用浓硫酸配制过程①所需的250mL 3.0mol•L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶、胶头滴管.
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有坩埚(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的c吸收.
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是铁,检验溶液X中金属阳离子是否完全转化的试剂为硫氰化钾溶液(填试剂名称).
(4)过程④的操作是将溶液蒸发浓缩、冷却结晶、过滤、洗涤,即得到FeSO4•7H2O晶体.过程⑥中,将溶液Z加热到70~80℃,目的是促进Fe3+的水解.
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验.①用分析天平称取样品3.200g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g.若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为26.25%.
分析 烧渣中加入稀硫酸、同时通入氧气,过滤后,得到固体W中含有S、SiO2,再灼烧后尾气中含有二氧化硫.溶液X含有Fe2(SO4)3及未反应的硫酸,溶液X中加入Fe粉,反应完毕,过滤得到溶液Y为FeSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到绿矾.溶液X调节pH得到溶液Z,加热促进Fe3+的水解得到聚铁胶体,再经过胶体聚沉得到聚铁,通过调节pH可以控制氢氧化铁与硫酸铁的比例关系.
(1)用浓硫酸配制250mL 3.0mol•L-1的稀硫酸,需要玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管;
(2)过程②为固体灼烧,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有坩埚;
该过程产生的尾气中含有二氧化硫,选择的吸收剂能很好的溶解二氧化硫或与二氧化硫反应,但不能产生新的有害气体;
(3)过程③中将硫酸铁转化为硫酸亚铁,加入Fe粉;溶液X中金属阳离子为Fe3+,利用KSCN溶液检验是否完全转化;
(4)从溶液中获得晶体,需要经过加热蒸发浓缩、冷却结晶、过滤、洗涤等操作;
将溶液Z加热到70~80℃有利于铁离子水解的进行;
(5)步骤③中得到3.495g固体为BaSO4沉淀,根据n=$\frac{m}{M}$计算BaSO4的物质的量,根据硫酸根守恒,可以计算聚铁中硫酸根的物质的量,结合聚铁中Fe与硫酸根比例关系计算Fe的物质的量,再根据m=nM计算铁元素质量,进而计算铁元素质量分数.
解答 解:烧渣中加入稀硫酸、同时通入氧气,过滤后,得到固体W中含有S、SiO2,再灼烧后尾气中含有二氧化硫.溶液X含有Fe2(SO4)3及未反应的硫酸,溶液X中加入Fe粉,反应完毕,过滤得到溶液Y为FeSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到绿矾.溶液X调节pH得到溶液Z,加热促进Fe3+的水解得到聚铁胶体,再经过胶体聚沉得到聚铁,通过调节pH可以控制氢氧化铁与硫酸铁的比例关系.
(1)用浓硫酸配制250mL 3.0mol•L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要250mL容量瓶、胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)过程②为固体灼烧,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有坩埚;
该过程产生的尾气中含有二氧化硫,浓硫酸不能吸收二氧化硫,二氧化硫在水溶解度虽然较大,亚硫酸溶于易挥发得到二氧化硫,但不宜使用水吸收进行处理,氢氧化钠与硝酸都能与二氧化硫反应,但硝酸反应会产生氮的氧化物,而污染空气,应选择NaOH,
故答案为:坩埚;c;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,过程③中需要加入Fe粉;溶液X中金属阳离子为Fe3+,利用KSCN溶液检验是否完全转化,取反应后的溶液少许于试管中,加入KSCN溶液,若溶液不变红色,说明反应完全,若溶液变为红色,说明未反应完全,
故答案为:铁;硫氰化钾溶液;
(4)从硫酸亚铁溶液中获得FeSO4•7H2O晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作;
过程⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:蒸发浓缩、冷却结晶;促进Fe3+的水解;
(5)步骤③中得到3.495g固体为BaSO4沉淀,其物质的量为$\frac{3.495g}{233g/mol}$=0.015mol,根据硫酸根守恒,可以计算聚铁中硫酸根为0.015mol,结合聚铁中Fe与硫酸根比例关系可知Fe的物质的量为0.015mol,故铁元素质量分数为$\frac{0.015mol×56g/mol}{3.200g}$×100%=26.25%,
故答案为:26.25%.
点评 本题考查物质制备方案、溶液配制、物质的分离提纯、基本操作、对条件控制的分析评价、物质组成含量的测定等,是对学生综合能力的考查,需要学生具备扎实的基础,(5)中注意利用守恒法计算硫酸根物质的量,再结合化学式计算,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)滴定至终点的判断方法当滴入最后一滴NaOH溶液,溶液颜色由无色变为浅红色(或红色),半分钟内不褪色
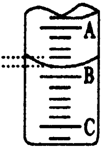
(3)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度
为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.该NaOH标准液保存时间过长,有部分变质,浓度降低
F.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C=$\frac{\frac{25.35mL+25.30mL}{2}×cmol•{L}^{-1}}{VmL}$.

 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:

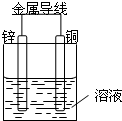 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题: