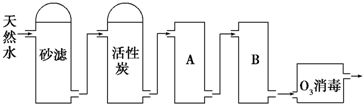
题目内容
1.有X、Y、Z、W四种元素,已知:(1)它们都是短周期元素,X和Z在同一周期;在常温下W元素的单质是黄绿色气体(2)它们可以组成:X2Z、ZY2、ZY3 化合物;(3)ZY3与水化合生成一种常见的强酸,此强酸与X2Z发生复分解反应生成一种气体A.根据以上推断回答下列问题:
(1)X、Y、W的元素符号依次为:Na、O、Cl.
(2)画出 z2-的原子结构示意图:

(3)比较Y、Z 氢化物的稳定性H2O>H2S
(4)比较X、Y、Z、W简单离子半径的大小S2->Cl->O2->Na+
(5)用电子式表示 X2Z 的形成过程:

(6)ZY3与水化合生成的强酸与X2Z反应的化学方程式为:H2SO4+Na2S=Na2SO4+H2S↑
(7)A和W元素的单质反应的化学反应方程式是:H2S+Cl2=S↓+2HCl
(8)X单质与Y单质在加热时得到的产物中含有的化学键有离子键、共价键.
分析 有X、Y、Z、W四种元素,它们都是短周期元素,在常温下W元素的单质是黄绿色气体,则W为Cl元素;它们可以组成:X2Z、ZY2、ZY3 化合物,而ZY3与水化合生成一种强酸,应是SO3与水反应生成硫酸,可推知Y为O、Z为S,X和Z在同一周期,由形成的化合物可知X为+1价,则X为Na,硫酸与Na2S反应可生成一种气体A为H2S,验证符合题意,据此解答.
解答 解:有X、Y、Z、W四种元素,它们都是短周期元素,在常温下W元素的单质是黄绿色气体,则W为Cl元素;它们可以组成:X2Z、ZY2、ZY3 化合物,而ZY3与水化合生成一种强酸,应是SO3与水反应生成硫酸,可推知Y为O、Z为S,X和Z在同一周期,由形成的化合物可知X为+1价,则X为Na,硫酸与Na2S反应可生成一种气体A为H2S,验证符合题意,
(1)由上述分析可知,X、Y、W四种元素的元素符号依次为:Na、O、Cl,故答案为:Na;O;Cl;
(2)S2-离子核外有18个电子层,有3个电子层,各层电子数为2、8、8,结构示意图为 ,故答案为:
,故答案为: ;
;
(3)非金属性O>S,故氢化物稳定性为H2O>H2S,故答案为:H2O>H2S;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->O2->Na+,故答案为:S2->Cl->O2->Na+;
(5)用电子式表示 Na2S 的形成过程为 ,
,
故答案为: ;
;
(6)硫酸与Na2S反应生成硫酸钠与硫化氢,化学方程式为:H2SO4+Na2S=Na2SO4+H2S↑,故答案为:H2SO4+Na2S=Na2SO4+H2S↑;
(7)硫化氢与氯气反应生成S与HCl,化学反应方程式为H2S+Cl2=S↓+2HCl,故答案为:H2S+Cl2=S↓+2HCl;
(8)X单质与Y单质在加热时得到的产物为Na2O2,含有离子键、共价键,故答案为:离子键、共价键.
点评 本题考查结构性质位置关系应用,侧重对化学用语的考查,推断元素是解题关键,注意掌握用电子式表示化学键或物质的形成过程,难度中等.

| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯易溶于水 |
| A. | Al13与Al14互为同素异形体 | |
| B. | Al13超原子中Al原子间是通过离子键结合的 | |
| C. | Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI=Al14I2+H2↑ | |
| D. | Al13在一定条件下能和镁作用生成Mg(Al13)2 |
| A. | Mg和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Na和Zn |
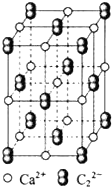 乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔.
乙炔是有机合成工业的一种原料.工业上曾用CaC2与水反应生成乙炔. ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.