题目内容
5.可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),该可逆反应在10L的密闭容器中进行,30秒后,水蒸气的物质的量增加了0.45mol,请分别用NH3、O2、NO、H2O表示该可逆反应的化学反应速率?分析 根据v=$\frac{△c}{△t}$计算v(H2O),再利用速率之比等于化学计量数之比计算各物质表示的反应速率,进行判断.
解答 解:在体积10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,
速率之比等于化学计量数之比,所以v(NH3)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.0010mol•L-1•s-1;
速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{6}$×0.0015mol•L-1•s-1=0.00125mol•L-1•s-1;
速率之比等于化学计量数之比,所以v(NO)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.0010mol•L-1•s-1;
答:分别用NH3、O2、NO、H2O表示该可逆反应的化学反应速率分别为:0.0010mol•L-1•s-1;0.00125mol•L-1•s-1;0.0010mol•L-1•s-1;
点评 本题考查化学反应速率的计算,难度不大,注意公式的运用,化学反应速率的计算通常有定义法、化学计量数法,根据题目选择合适的计算方法.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
20.下列说法中正确的是( )
| A. | ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子 | |
| B. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| D. | 碱金属和卤素单质的熔沸点均随原子序数的增大而逐渐升高 |
14.下列叙述中,通常不能作为判断两种元素非金性强弱的依据的是( )
| A. | 其气态氢化物的稳定性 | |
| B. | 单质的氧化性的强弱 | |
| C. | 其最高价氧化物对应的水化物的酸碱性 | |
| D. | 单质的熔点高低 |
15. 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:2X(g)+2Y(g)?Z(g) |
 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.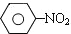 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$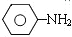 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化) $\stackrel{KMnO_{4}、H+}{→}$
$\stackrel{KMnO_{4}、H+}{→}$
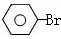 $→_{高温、加压}^{NaOH溶液、催化剂}$
$→_{高温、加压}^{NaOH溶液、催化剂}$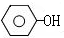
 (对氨基水杨酸钠)
(对氨基水杨酸钠)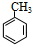 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$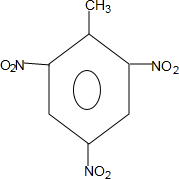 +3H2O
+3H2O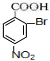 D:
D: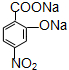 ;
;