题目内容
10.短周期元素A、B、C、D、E位于同周期且原子序数依次增大.已知A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应.D原子最外层的电子数是次外层的一半.请完成下列各小题:(1)A、B、C三种元素最高价氧化物对应水化物中,碱性最强的是NaOH(用化学式表示)
(2)指出元素E在元素周期表中的位置:第三周期第ⅥA族.
(3)元素C的氯化物属于共价化合物(填“离子”或“共价”)
(4)A、C元素的最高价氧化物对应水化物之间反应的离子方程式为OH-+Al(OH)3=AlO2-+H2O.
(5)在生活中,常利用C的单质与Fe2O3在高温下的反应来进行焊接钢轨.请写出该反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.该反应属于放热反应(填“吸热”或“放热”)
(6)D元素的单质在生产和生活中有广泛的应用,请写出工业上制备D单质(粗产品)的化学反应方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.请举出D的单质在生产和生活中的一种应用半导体材料、太阳能电池.
分析 短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性越强,最高价氧化物对应水化物的碱性越强;
(2)主族元素周期数=电子层数、主族族序数=最外层电子数;
(3)氯化铝属于共价化合物;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水;
(5)Al与氧化铁在高温下反应生成氧化铝与Fe,该反应为铝热反应,放出大量的热;
(6)工业上制备Si,用碳与二氧化硅反应生成Si与CO,硅是良好的半导体材料、可以用作太阳能电池等.
解答 解:短周期元素A、B、C、D、E位于同周期且原子序数依次增大.A、C、E三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化物之间两两皆能反应,均生成盐和水,为氢氧化铝与强碱、强酸的反应,故A为Na、C为Al,B为Mg元素,E原子最外层电子数为10-1-3=6,则E为硫元素;D原子最外层的电子数是次外层的一半,处于第三周期,最外层电子数为4,故D为Si.
(1)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH;
(2)E为硫元素,原子有3个电子层,最外层电子数为6,处于周期表第三周期第ⅥA族,故答案为:三;ⅥA;
(3)氯化铝属于共价化合物,故答案为:共价;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3=AlO2-+H2O,故答案为:OH-+Al(OH)3=AlO2-+H2O;
(5)Al与氧化铁在高温下反应生成氧化铝与Fe,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为铝热反应,放出大量的热,属于放热反应,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;放热;
(6)工业上用碳与二氧化硅反应制备硅,反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,硅是良好的半导体材料、可以用作太阳能电池等,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;半导体材料、太阳能电池.
点评 本题考查结构性质位置关系应用等,难度不大,推断元素是解题的关键,注意基础知识的理解掌握.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 小苏打可以用作胃溃疡患者的胃酸中和剂 | |
| B. | 二氧化硫可以用来漂白纸浆、毛、丝、草帽辫、银耳、米粉等 | |
| C. | 飞机播撒碘化银或干冰可实现人工降雨 | |
| D. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸 |
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |
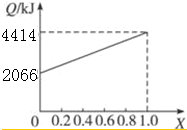
A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
| A. | 用高效催化剂,可提高CO2的利用率 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的利用率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
| A. | 氮原子的价电子排布图: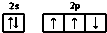 | |
| B. | 2p和3p轨道形状均为哑铃形,能量也相等 | |
| C. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| D. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 |
 ,该化合物是由离子键形成.
,该化合物是由离子键形成.