题目内容
13.据报导,目前我国结核病的发病率有抬头的趋势.抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种.已知:①
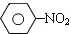 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$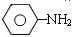 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)②
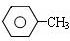 $\stackrel{KMnO_{4}、H+}{→}$
$\stackrel{KMnO_{4}、H+}{→}$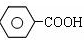
③
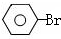 $→_{高温、加压}^{NaOH溶液、催化剂}$
$→_{高温、加压}^{NaOH溶液、催化剂}$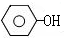
下面是PAS-Na的一种合成路线(部分反应的条件未注明):
A$→_{浓硝酸、△}^{浓硫酸}$BC7H6BrNO2$\stackrel{试剂X}{→}$C$→_{高温、加压}^{NaOH溶液、催化剂}$D→E$\stackrel{试剂Y}{→}$
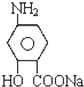 (对氨基水杨酸钠)
(对氨基水杨酸钠)按要求回答问题:
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出由A制取TNT的化学反应方程式
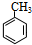 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$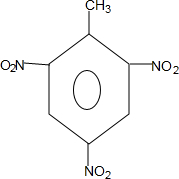 +3H2O
+3H2O(2)写出各物质的结构简式C:
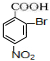 D:
D: ;
;(3)写出所加试剂的化学式X:KMnO4Y:NaHCO3.
(4)上述合成路线中,分子式为C7H6BrNO2的官能团名称为硝基、溴原子,与它具有相同官能团并属于芳香族化合物的同分异构体有17种(含M本身).
分析 由对氨基水杨酸钠的结构可知A应为 ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成B,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成B,则B为 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为 ,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,
,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应, 被酸性高锰酸钾氧化生成C,则C为
被酸性高锰酸钾氧化生成C,则C为 ,C在碱性条件下水解生成D为
,C在碱性条件下水解生成D为 ,D在Fe、HCl、水条件下发生还原生成E,则E为
,D在Fe、HCl、水条件下发生还原生成E,则E为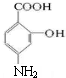 ,E与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
,E与碳酸氢钠反应生成氨基水杨酸钠,以此解答该题.
解答 解:(1)由对氨基水杨酸钠的结构可知A应为 ,苯甲酸能够与浓硝酸反应生成TNT,反应方程式为:
,苯甲酸能够与浓硝酸反应生成TNT,反应方程式为: +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$ +3H2O,故答案为:
+3H2O,故答案为: +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;
(2)B为 ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为 ,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,
,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应, 被酸性高锰酸钾氧化生成C,则C为
被酸性高锰酸钾氧化生成C,则C为 ,C在碱性条件下水解生成D为
,C在碱性条件下水解生成D为 ,故答案为:
,故答案为: ;
; ;
;
(3) 被酸性高锰酸钾氧化生成C,E与碳酸氢钠反应生成氨基水杨酸钠,故答案为:KMnO4;NaHCO3;
被酸性高锰酸钾氧化生成C,E与碳酸氢钠反应生成氨基水杨酸钠,故答案为:KMnO4;NaHCO3;
(4)C7H6BrNO2的结构简式为 ,含有的官能团有溴原子,硝基;与
,含有的官能团有溴原子,硝基;与 具有相同官能团的同分异构体并属于芳香族化合物可以为苯环上连有三个基团的即-CH3、-NO2、-Br,根据定二动一的原则,这样的结构有10种(含M本身),或两个基团的即-CH2Br、-NO2或-CH2NO2、-Br,含有邻、间、对位置,这样的结构共有6种,或含有一个基团-CH(Br)NO2,所以共有17种,
具有相同官能团的同分异构体并属于芳香族化合物可以为苯环上连有三个基团的即-CH3、-NO2、-Br,根据定二动一的原则,这样的结构有10种(含M本身),或两个基团的即-CH2Br、-NO2或-CH2NO2、-Br,含有邻、间、对位置,这样的结构共有6种,或含有一个基团-CH(Br)NO2,所以共有17种,
故答案为:硝基、溴原子;17.
点评 本题考查有机物的推断,题目难度中等,注意①-COOH由-CH3氧化而来,②-NH2由-NO2还原而得,故第一步反应-NO2引入到-CH3的对位上,③-OH由-X水解得,故第二步反应-Br引入到-CH3的邻位上,答题时注意体会.

| A. | (m-x)n | B. | W(m-x-n)n | C. | $\frac{W}{m}$(m-x+n) | D. | $\frac{m-x+n}{mW}$ |
| A. | 小苏打可以用作胃溃疡患者的胃酸中和剂 | |
| B. | 二氧化硫可以用来漂白纸浆、毛、丝、草帽辫、银耳、米粉等 | |
| C. | 飞机播撒碘化银或干冰可实现人工降雨 | |
| D. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸 |
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |
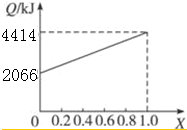
A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图.
(1)A、B的相对分子质量为A32,B114.
(2)等物质的量的A、B混合的燃料73 g,在160L O2中完全燃烧,反应后气体通过浓硫酸后,得到104L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定).由此可推得混合物中N(C):N(H):N(O)=9:22:1,A分子式为CH4O,B分子式为C8H18.
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2980 kJ,则反应中生成CO0.5
mol.
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
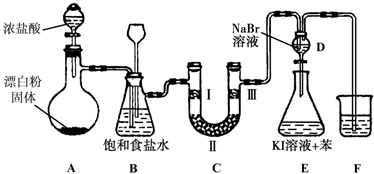
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,请写出该反应相应的化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是d(填字母编号).
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是吸收多余的氯气,防止污染大气,其烧杯中的溶液 不能选用下列中的b(填字母编号).
a.饱和NaOH溶液
b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液
d.饱和Na2CO3溶液.
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.