题目内容
20.下列说法中正确的是( )| A. | ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子 | |
| B. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| D. | 碱金属和卤素单质的熔沸点均随原子序数的增大而逐渐升高 |
分析 A、半径越大,原子核对最外层电子吸引能力减弱;
B、主族元素的金属阳离子的电子层数不等于该元素所在周期数;
C、根据元素周期表中过渡元素的分布来回答;
D、碱金属单质溶沸点随原子序数递增减小.
解答 解:A、半径越大,原子核对最外层电子吸引能力减弱,所以半径越大,越容易失去电子,故A错误;
B、原子的核外电子层数等于该元素所在的周期数,但主族元素的金属阳离子的电子层数不等于该元素所在周期数,如钠离子有2个电子层,但钠在第三周期,故B错误;
C、元素周期表中从IIIB族到IIB族10个纵行的元素都是过渡元素,过渡元素全部为金属元素,故C正确;
D、依据金属键特征分析,碱金属单质是金属晶体,溶沸点随原子序数递增减小,卤素的单质是分子晶体,熔沸点随原子序数递增依次升高,故D错误;
故选C.
点评 本题考查元素周期表的结构及元素在周期表中的位置,熟悉元素的位置及原子结构的关系、同周期元素的变化规律即可解答,难度不大.

练习册系列答案
相关题目
19.为了测定“铁块”中铁元素的含量,实验流程如图所示:

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
(1)试剂A应选择C,试剂B应选择D(填序号)
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
11.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能( )
| A. | x+2 | B. | x+4 | C. | x+18 | D. | x+34 |
15.下列表示的是N原子的轨道表示式: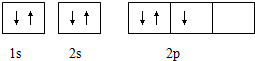 它违背了( )
它违背了( )
 它违背了( )
它违背了( )| A. | 能量守恒原理 | B. | 能量最低原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
12.下列叙述正确的是( )
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 某元素原子最外层只有两个电子,它一定是金属元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
9.下列各物质中,能形成顺、反异构体的是( )
| A. | CCl2═CH2 | B. | CH3-CH═CH2 | C. | CH3-CH═CH-CH3 | D. | CH2═CH-CH2-CH3 |
10.下列说法正确的是( )
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 | |
| C. | 酸与碱发生中和反应时放出的热量叫中和热 | |
| D. | 催化剂不但能改变反应速率,也能改变反应进行的限度 |
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.