题目内容
4.请根据以下信息,以CH2═CH-CH═CH2为基原料合成 ,写出各步反应的化学方程式.
,写出各步反应的化学方程式.①2CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OCH2CH3+H2O
②CH2═CH-CH═CH2与等物质的量的Br2反应生成CH2Br-CH═CH-CH2Br.
分析 以CH2═CH-CH═CH2为基原料合成 ,根据信息①逆推首先合成HOCH2CH2CH2CH2OH,根据卤代烃水解生成醇可知:需由BrCH2CH2CH2CH2Br→HOCH2CH2CH2CH2OH,根据信息②,BrCH2CH2CH2CH2Br可由CH2Br-CH═CH-CH2Br与氢气加成得到,CH2Br-CH═CH-CH2Br由CH2═CH-CH═CH2与等物质的量的Br2反应所得,据此分析解答.
,根据信息①逆推首先合成HOCH2CH2CH2CH2OH,根据卤代烃水解生成醇可知:需由BrCH2CH2CH2CH2Br→HOCH2CH2CH2CH2OH,根据信息②,BrCH2CH2CH2CH2Br可由CH2Br-CH═CH-CH2Br与氢气加成得到,CH2Br-CH═CH-CH2Br由CH2═CH-CH═CH2与等物质的量的Br2反应所得,据此分析解答.
解答 解:以CH2═CH-CH═CH2为基原料合成 ,需经历以下步骤:
,需经历以下步骤:
①CH2═CH-CH═CH2与等物质的量的Br2反应:CH2═CH-CH═CH2+Br2→CH2Br-CH═CH-CH2Br,
②烯烃与氢气的加成反应:CH2Br-CH═CH-CH2Br+H2$→_{△}^{催化剂}$BrCH2CH2CH2CH2Br,
③卤代烃的水解:BrCH2CH2CH2CH2Br+2H2O$→_{△}^{NaOH}$HOCH2CH2CH2CH2OH+2HBr,
④HOCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$ +H2O,
+H2O,
答:CH2═CH-CH═CH2+Br2→CH2Br-CH═CH-CH2Br,CH2Br-CH═CH-CH2Br+H2$→_{△}^{催化剂}$BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br+2H2O$→_{△}^{NaOH}$HOCH2CH2CH2CH2OH+2HBr,HOCH2CH2CH2CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.
点评 本题考查有机物的合成,综合考查学生分析能力、推断能力和综合运用化学知识的能力,题目难度不大,注意比较各有机物的组成和结构,注意把握有机物的官能团的性质.

练习册系列答案
相关题目
14.如图Ⅰ是NO2(g)+CO(g)═CO2(g)+NO(g) 反应过程中能量示意图.一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ.下列有关说法正确的是( )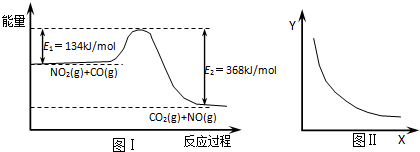

| A. | 该反应的焓变△H=234kJ/mol | |
| B. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| C. | 若X表示反应时间,则Y表示的可能是混合气体的密度 | |
| D. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 |
15.下列有关反应限度的叙述正确的是( )
| A. | 大多数化学反应在一定条件下都有一定的限度 | |
| B. | 化学反应在一定条件下达到限度时,正、逆反应速率都等于零 | |
| C. | 当某反应体系中气体压强不在改变时,该反应一定达到了反应限度 | |
| D. | 当某反应在一定条件下达到反应限度时,反应物和生成物的浓度一定相等 |
19.为了测定“铁块”中铁元素的含量,实验流程如图所示:

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
(1)试剂A应选择C,试剂B应选择D(填序号)
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
4.已知mRn-阴离子的原子核内有x个中子,WgmRn-阴离子含有的电子的物质的量为( )
| A. | (m-x)n | B. | W(m-x-n)n | C. | $\frac{W}{m}$(m-x+n) | D. | $\frac{m-x+n}{mW}$ |