题目内容
【题目】[2019·福建省厦门市高中毕业班5月第二次质量检查]一种以磷酸工业副产物磷石膏(主要成分为CaSO4,杂质含H3PO4,SiO2,Al2O3等)制取高纯硫酸钙的流程如图所示。
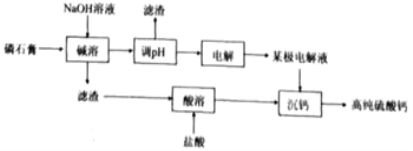
(1)磷石膏废弃会造成的环境问题为___________;
(2)“碱溶”中Al2O3发生反应的化学方程式为_________;
(3)含硅与含铝组分分布系数与pH关系如下图:
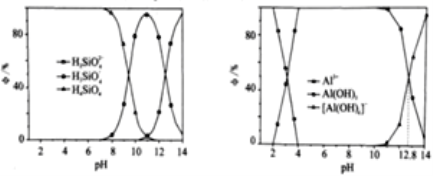
①“调pH”时,溶液的pH应调节为__________;
②Ksp[Al(OH)3]=__________;
③Al(OH)3(aq)+H2O![]() [Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
[Al(OH)4](aq)+H+(aq),则Ka[Al(OH)3]=__________;
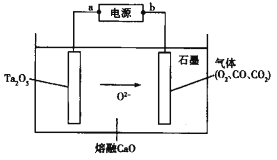
(4)“电解”采用双极膜电渗析法,装置如下图。
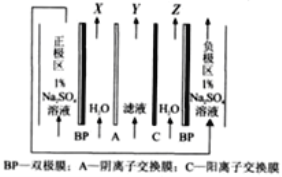
①“某极电解液”为________(填“X”、“Y”或“Z”)极。
②阴极电极反应式为____________。
(5)流程中可循环利用的物质有________________(填化学式)。
【答案】水体富营养化 Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 7 1.0×10-33 10-12.8 X 2H++2e-=H2↑ NaOH、HCl
【解析】
(1)磷元素是植物生长需要的营养元素,磷石膏废弃会造成的环境问题为水体富营养化;
(2) Al2O3是两性氧化物,可以与强碱反应产生盐和水;
(3)①调整溶液的pH,使Si元素形成沉淀,而Al元素以[Al(OH)4]-存在于溶液中;
②根据形成Al(OH)3沉淀的pH分析Ksp[Al(OH)3]大小;
③根据电离平衡常数的概念计算;
(4)①根据某极电解液的作用是沉钙,分析所属电极名称;
②根据阴极上溶液中的阳离子放电,结合离子的放电顺序分析判断;
③根据两个电极放电后产生的物质分析循环利用的物质。
(1)磷元素是植物生长需要的营养元素,在磷石膏中含有H3PO4,若磷石膏废弃,磷酸溶于水,会电离产生H2PO4-、HPO42-,为植物生长提供营养元素,使植物疯狂生长,故磷石膏废弃会造成的环境问题为水体富营养化;
(2) Al2O3是两性氧化物,可以与NaOH溶于发生反应产生Na[Al(OH)4],反应方程式为Al2O3+2NaOH+3H2O=2Na[Al(OH)4];
(3)①根据图象可知在溶液的pH=7时,Si元素以H4SiO4沉淀的形式存在,而Al元素以Al(OH)3沉淀的形式存在,故调整溶液的pH=7;
②由图象可知:当溶液的pH大约为pH=3时形成Al(OH)3沉淀,c(H+)=10-3,则根据水的离子积常数可得此时溶液中c(OH-)=![]() =10-11,则Ksp[Al(OH)3]=1×(10-11)3=10-33;
=10-11,则Ksp[Al(OH)3]=1×(10-11)3=10-33;
③对于电离平衡:Al(OH)3(aq)+H2O![]() [Al(OH)4]-(aq)+H+(aq),当溶液的Al(OH)3(aq)的浓度与[Al(OH)4]-(aq)的浓度相等时,Ka[Al(OH)3]等于溶液中氢离子的浓度,所以Ka[Al(OH)3]=
[Al(OH)4]-(aq)+H+(aq),当溶液的Al(OH)3(aq)的浓度与[Al(OH)4]-(aq)的浓度相等时,Ka[Al(OH)3]等于溶液中氢离子的浓度,所以Ka[Al(OH)3]=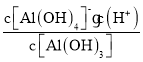 =c(H+)=10-12.8;
=c(H+)=10-12.8;
(4)①“某极电解液”作用是沉钙,应该为酸溶液,在电解装置中,左边为正极区,OH-向正极区移动,H+向X区移动,因此X区溶液为酸性溶液,故“某极电解液”为X极;
②在负极区,H+发生还原反应产生氢气,因此阴极电极反应式为2H++2e-=H2↑;
③H+向X电极移动,Cl-移向X电极区,Na+移向Z电极区,OH-向Z电极区移动,所以X电极区产生HCl,Z电极区产生NaOH,反应产生的HCl、NaOH又可以在酸溶、碱溶中使用,故流程中可循环利用的物质有HCl、NaOH。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少___?
(2)合金中镁铝的质量分数各是多少___、___?