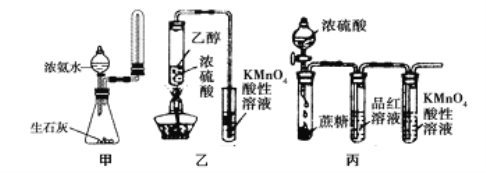
题目内容
【题目】下列说法中,正确的是
A.22.4 L O3中一定含有3 mol O
B.常温常压下28 g N2和28 g CO中含有的原子个数相等
C.将10 g CaCO3投入水中再加水至100 mL,所得溶液中Ca2+物质的量浓度为1 mol/L
D.在标准状况下11.2 L H2O中含有1 mol H
【答案】B
【解析】
A. 非标准状况下,22.4 L O3的物质的量不一定是1mol,所以不一定含有3 mol O,故A错误;
B. 常温常压下28 g N2含有原子的物质的量是![]() ,28 g CO含有原子的物质的量是
,28 g CO含有原子的物质的量是![]() ,故B正确;
,故B正确;
C. CaCO3难溶于水,将10 g CaCO3投入水中再加水至100 mL,CaCO3不能完全溶解,所得溶液中Ca2+物质的量浓度小于1mol/L,故C错误;
D. 在标准状况下H2O是液体,11.2 L H2O的物质的量不是0.5mol,所以氢原子的物质的量不是1mol,故D错误;
选B。

 名校课堂系列答案
名校课堂系列答案【题目】FeCl2是一种常用的还原剂,有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl,C6H4Cl2,苯,易吸水 | ||
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
实验室可以用多种方法来制备无水FeCl2。回答下列问题:
Ⅰ.按下如图装置用H2还原无水FeCl3制取。
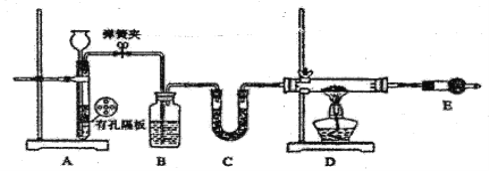
(1)用装置A制取H2,其优点是________________;D中反应的化学方程式为____________________;装置E的作用是____________________________。
(2)通入足量H2,充分反应,如果温度控制不当,产品中会含单质铁,检验产品中是否含铁的方案是____________________________。
Ⅱ.按图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
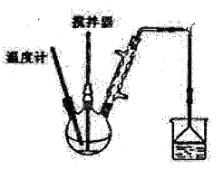
(3)上述反应中,还原剂是____________。
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是____________________________。
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品。
①洗涤所用的试剂可以是____________________________;
②简述回收滤液中C6H5Cl的方案____________________________。