题目内容
【题目】甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少___?
(2)合金中镁铝的质量分数各是多少___、___?
【答案】0.20mol·L-1 47.1% 52.9%
【解析】
对比甲乙丙的数据,甲到乙合金的质量增加,生成的氢气的体积也增加,说明甲中盐酸过量,合金全部溶解,乙到丙合金的质量增加,生成的氢气的体积不变,说明丙中盐酸不足,合金不能全溶解,合金有剩余。
(1)由分析可知,丙中盐酸不足,则根据系数关系可得c(HCl)=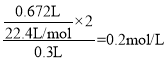 ,故答案为:0.20mol·L-1;
,故答案为:0.20mol·L-1;
(2)甲中合金都溶解,则有24×n(Mg)+27n(Al)=0.51g,2 n(Mg)+3n(Al)=2×![]() =0.05mol,解得n(Mg)=0.01mol,n(Al)=0.01mol,则镁的质量分数为
=0.05mol,解得n(Mg)=0.01mol,n(Al)=0.01mol,则镁的质量分数为![]() =47.1%,铝的质量分数为
=47.1%,铝的质量分数为![]() =52.9%,故答案为:47.1%;52.9%。
=52.9%,故答案为:47.1%;52.9%。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目