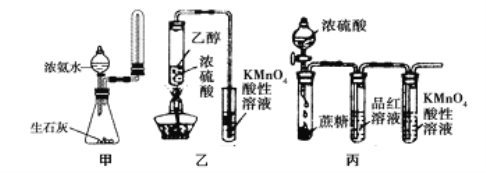
题目内容
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)。
(3)在400℃时,向初始体积为1L的恒压密闭反应器中充入1 molCH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为20.0%。则:
①在该温度下,其平衡常数K=________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率将_______(填“増大”“减小”“不变”或“无法确定”),理由是__________________________________。
③若反应器的体积固定,不同压强下可得变化如下图所示,则压强的关系是____________。

④实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H6(g)+H2(g)。反应器和CH4起始量不変,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如下图所示。
C2H6(g)+H2(g)。反应器和CH4起始量不変,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如下图所示。

I.在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
II.若在400℃时,C2H4、C2H6的体积分数分别为20.0%、6.0%,其余为CH4和H2,则体系中CH4的体积分数是____________。
【答案】2CH4(g)![]() C2H4(g)+2H2(g)△H=+202.0kJ/mol
C2H4(g)+2H2(g)△H=+202.0kJ/mol ![]() 0.20mol/L 增大 反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大 p1>p2 乙炔 28%
0.20mol/L 增大 反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大 p1>p2 乙炔 28%
【解析】
(1)根据表格中数据书写H2、CH4、C2H4燃烧热的热化学方程式,由盖斯定律计算;
(2)X的分子式C2H4O,不含双键,判断出X的结构简式;
(3)①根据三段式结合平衡混合气体中C2H4的体积分数为20.0%计算;
②通入高温水蒸气,相当于加热和减小压强,根据(2)中的反应并结合平衡的影响因素分析解答;
③若容器体积固定,根据反应的特征结合压强对平衡的影响分析判断;
④由图可知,温度高于600℃时,有较多的自由基![]() 生成;
生成;
(4)设最终气体的总物质的量为x,计算出平衡时C2H4、C2H6和氢气的物质的量,再计算甲烷的体积分数。
(1)根据表格中数据有:①H2(g)+![]() O2(g)═H2O(l)△H1=-285.8kJ/mol,②CH4(g)+2O2(g)
O2(g)═H2O(l)△H1=-285.8kJ/mol,②CH4(g)+2O2(g)
=CO2(g)+2H2O(l)△H2=-890.3kJ/mol,③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H3=-1411.0kJ/mol
,甲烷制备乙烯的化学方程式为:2CH4(g) ![]() C2H4(g)+2H2(g),根据盖斯定律,将②×2-③-①×2得到,2CH4(g)
C2H4(g)+2H2(g),根据盖斯定律,将②×2-③-①×2得到,2CH4(g) ![]() C2H4(g)+2H2(g) △H=2△H2-△H3-2△H1=+202.0kJ/mol,故答案为:2CH4(g)
C2H4(g)+2H2(g) △H=2△H2-△H3-2△H1=+202.0kJ/mol,故答案为:2CH4(g) ![]() C2H4(g)+2H2(g)△H=+202.0kJ/mol;
C2H4(g)+2H2(g)△H=+202.0kJ/mol;
(2)由题意乙烯与氧气催化制备X,X的分子式C2H4O,不含双键,反应符合最理想的原子经济可知,X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)①400℃时,向1L的恒容反应器中充入1mol CH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0%,由此建立如下三段式:
2CH4(g) ![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起始(mol) 1 0 0
转化(mol) 2x x 2x
平衡(mol) 1-2x x 2x
由平衡混合气体中C2H4的体积分数为20.0%得![]() =20.0%,解得x=0.25,平衡后气体的体积=
=20.0%,解得x=0.25,平衡后气体的体积=![]() ×1L=1.25L,所以化学平衡常数为K=
×1L=1.25L,所以化学平衡常数为K=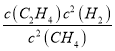 =
=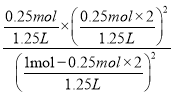 =
=
0.20mol/L,故答案为:0.20mol/L;
②甲烷制备乙烯的反应为气体体积增大的吸热反应,通入高温水蒸气(不参加反应,高于400℃)相当于加热,平衡右移,产率增大;同时通入水蒸气,容器的体积增大,相当于减小压强,平衡右移,产率也增大,因此C2H4的产率将增大,故答案为:增大;该反应为气体体积增大的吸热反应,通入高温水蒸气相当于加热,同时通入水蒸气,容器的体积增大,相当于减小压强,平衡均右移,产率增大;
③若容器体积固定,甲烷制备乙烯的反应为气体体积增大的反应,温度相同时,增大压强平衡向逆反应方向移动,CH4的平衡转化率降低,因此p1>p2,故答案为:p1>p2;
④由图可知,温度高于600℃时,有较多的自由基![]() 生成,自由基结合生成
生成,自由基结合生成![]() ,则双碳有机副产物为乙炔,故答案为:乙炔;
,则双碳有机副产物为乙炔,故答案为:乙炔;
(4)设最终气体的总物质的量为x,则C2H4为0.2x、C2H6为0.06x,根据2CH4(g) ![]() C2H4(g)+2H2(g)和2CH4(g)
C2H4(g)+2H2(g)和2CH4(g) ![]() C2H6(g)+H2(g)可知,生成的氢气为0.4x+0.06x=0.46x,则含有的甲烷为x-(0.2x+0.06x+0.46x)=0.28x,因此体系中CH4的体积分数=
C2H6(g)+H2(g)可知,生成的氢气为0.4x+0.06x=0.46x,则含有的甲烷为x-(0.2x+0.06x+0.46x)=0.28x,因此体系中CH4的体积分数=![]() ×100%=28%,故答案为:28%。
×100%=28%,故答案为:28%。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。