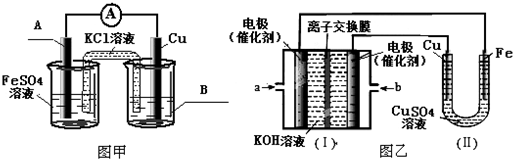
��Ŀ����
7���Ȼ�ͭ���Ȼ���ͭ����Ҫ�Ļ���ԭ�ϣ��������л��ϳɴ�����I��ʵ�������Դ�ͭ������������Ϊԭ���Ʊ�ͭ���Ȼ��������ͼ1��ʾ��ʵ��������ҩƷ���Ʊ�����������������������ͭ��Ӧ������̨�����С��ƾ�����ʡ�ԣ���
��ش�
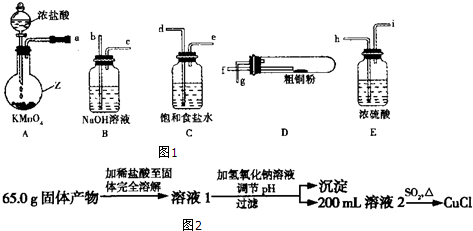
��1��װ��A������Z������ΪԲ����ƿ��
��2���������������Ӹ��������ӿ�˳��Ϊ��a��d��e��h��i��f��g��b��
��3����������װ��A�����ԵIJ���������ֹˮ�м�ס�����ܵ���Ƥ�ܣ��ӳ���©���м�ˮ��©�������γ�Һ��߶Ȳһ��ʱ���ڣ�Һ��߶Ȳ�䣬˵�����������ã�
��4��D�з�����Ӧ�Ļ�ѧ����ʽΪCu+Cl2$\frac{\underline{\;\;��\;\;}}{\;}$CuCl2��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��5����Ӧ��װ��B����Һ����Ư�ס��������ã����ø�������Fe��C����Ʒʢװ����Һ�ᷢ���绯ѧ��ʴ��������Ʒ�������ɺ��ɫ��������Һ��ʧȥƯ�ס�ɱ��������Ч���õ绯ѧ��ʴ������������ӦʽΪClO-+2e-+H2O=Cl-+2OH-��
������ʵ���ƵõĹ�����ﰴ��ͼ2�����̲�������ش�
��1����ϡ�����ܽ�����ԭ��Ϊ����Cu2+��Fe3+ˮ�⣮
��2����֪CuCl������ˮ������Һ2��CuCl�����ӷ���ʽΪ��2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$2CuCl��+4H++SO42-��
��3��������ķ����ⶨ��������е�CuCl2������������
ȡ2.00mL��Һ2ת�Ƶ���ƿ�У��ټ��������20%KI��Һ���ٵ��뼸�ε�����Һ����0.200mol/LNa2S2O3����Һ�ζ�����Ӧԭ��Ϊ2Cu2++4I-�T2CuI��+I2��I2+2S2O32-�TS4O62-+2I-���ظ��ζ�3�Σ�ƽ������Na2S2O3����Һ20.00mL������������CuCl2����������Ϊ83.1%����������λ��Ч���֣�
���� I����1������AΪԲ����ƿ��
��2��KMnO4��Ũ������ȡ��Cl2����HCl��H2O���ñ���ʳ��ˮ��ȥHCl����Ũ�����ȥH2O��Ȼ��Cl2��Cu��Ӧ�������NaOH��Һ����δ��Ӧ��Cl2����ֹ��Ⱦ������
��3������ֹˮ�м�ס�����ܵ���Ƥ�ܣ��ӳ���©���м�ˮ��©�������γ�Һ��߶Ȳһ��ʱ���ڣ�Һ��߶Ȳ�䣬˵�����������ã�
��4��D�з�����Ӧ�У�������Cu��Ӧ�����Ȼ�ͭ����Fe��Ӧ�����Ȼ�����
��5��װ��B����δ��Ӧ����������Ӧ����NaCl��NaClO��NaClO����Ư���ԣ�������Ʒ�������ɺ��ɫ��������Һ��ʧȥƯ�ס�ɱ��������Ч��˵��ClO-�������ϵõ��ӣ�������ԭ��Ӧ����Cl-������Ϊ����������������OH-��
��ͭ����Fe���Ʊ���CuCl2�к���FeCl3��CuCl2��FeCl3��Ϊǿ�������Σ��ܷ���ˮ�ⷴӦ��ˮ��������HCl����ϡ�����ܽ⣬�������Ȼ�ͭ���Ȼ���ˮ�⣬��������������Һ��������Һ��H+������pHʹ����Fe3+ת��Ϊ��������ȥ����Һ2����CuCl2��ͨ��һ������SO2�����ɳ���CuCl������������ԭ��Ӧ��SO2Ϊ��ԭ����������ΪSO42?��
��3����2Cu2++4I-=2CuI��+I2��I2+2S2O32-=S4O42-+2I-���ɵù�ϵʽ2n��ClCl2����I2��2n��S2O32-�����ݴ˼���200mL��Һ��n��ClCl2������������ClCl2������������
��� �⣺I����1������AΪԲ����ƿ���ʴ�Ϊ��Բ����ƿ��
��2��KMnO4��Ũ������ȡ��Cl2����HCl��H2O���ñ���ʳ��ˮ��ȥHCl����Ũ�����ȥH2O��Ȼ��Cl2��Cu��Ӧ�������NaOH��Һ����δ��Ӧ��Cl2����ֹ��Ⱦ�������ʰ������������������ӿ�˳��Ϊa��d��e��h��i��f��g��b���ʴ�Ϊ��d��e��h��i��f��g��b��
��3������Aװ�������Է���Ϊ������ֹˮ�м�ס�����ܵ���Ƥ�ܣ��ӳ���©���м�ˮ��©�������γ�Һ��߶Ȳһ��ʱ���ڣ�Һ��߶Ȳ�䣬˵�����������ã�
�ʴ�Ϊ������ֹˮ�м�ס�����ܵ���Ƥ�ܣ��ӳ���©���м�ˮ��©�������γ�Һ��߶Ȳһ��ʱ���ڣ�Һ��߶Ȳ�䣬˵�����������ã�
��4��D�з�����Ӧ�У�������Cu��Ӧ�����Ȼ�ͭ����Fe��Ӧ�����Ȼ�������Ӧ����ʽΪ��Cu+Cl2$\frac{\underline{\;\;��\;\;}}{\;}$CuCl2��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
�ʴ�Ϊ��Cu+Cl2$\frac{\underline{\;\;��\;\;}}{\;}$CuCl2��2Fe+3Cl2$\frac{\underline{\;\;��\;\;}}{\;}$2FeCl3��
��5��װ��B����δ��Ӧ����������Ӧ����NaCl��NaClO��NaClO����Ư���ԣ�������Ʒ�������ɺ��ɫ��������Һ��ʧȥƯ�ס�ɱ��������Ч��˵��ClO-�������ϵõ��ӣ�������ԭ��Ӧ����Cl-������Ϊ����������������OH-���õ绯ѧ��ʴ������������ӦʽΪ��ClO-+2e-+H2O=Cl-+2OH-���ʴ�Ϊ��ClO-+2e-+H2O=Cl-+2OH-��
��ͭ����Fe���Ʊ���CuCl2�к���FeCl3��CuCl2��FeCl3��Ϊǿ�������Σ��ܷ���ˮ�ⷴӦ��ˮ��������HCl����ϡ�����ܽ⣬�������Ȼ�ͭ���Ȼ���ˮ�⣬��������������Һ��������Һ��H+������pHʹ����Fe3+ת��Ϊ��������ȥ����Һ2����CuCl2��ͨ��һ������SO2�����ɳ���CuCl������������ԭ��Ӧ��SO2Ϊ��ԭ����������ΪSO42?��
��1��������������֪����ϡ�����ܽ�����ԭ���ǣ�����Cu2+��Fe3+ˮ�⣬�ʴ�Ϊ������Cu2+��Fe3+ˮ�⣻
��2����Һ2����CuCl2��ͨ��һ������SO2�����ɳ���CuCl������������ԭ��Ӧ��SO2Ϊ��ԭ����������ΪSO42?����Ӧ���ӷ���ʽΪ��2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$2CuCl��+4H++SO42-���ʴ�Ϊ��2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;��\;\;}}{\;}$2CuCl��+4H++SO42-��
��3����2Cu2++4I-=2CuI��+I2��I2+2S2O32-=S4O42-+2I-���ɵù�ϵʽ2n��ClCl2����I2��2n��S2O32-������200mL��Һ��n��ClCl2��=n��S2O32-��=0.02L��0.2mol/L��$\frac{200mL}{2mL}$=0.4mol������Ʒ��m��ClCl2��=0.4mol��135g/mol=54g����ClCl2����������Ϊ$\frac{54g}{65g}$��100%=83.1%���ʴ�Ϊ��83.1%��
���� ���⿼�����ʵ��Ʊ�ʵ�鷽������ѧ�������̣��漰��װ�ü������ķ������ۡ������Լ��顢�绯ѧ��ʴ���ζ�����ȣ������ڻ���֪ʶ���ۺ�Ӧ�ã��Ѷ��еȣ�

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�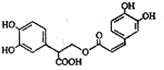
| A�� | �Ե�����ķ���ʽΪC18H15O8 | |
| B�� | �Ե�������Է����ӳɡ�ȡ������ɫ��Ӧ | |
| C�� | lmol�Ե������H2��Ӧ���������6mol H2 | |
| D�� | lmol�Ե�������NaOH��Һ�з�Ӧ���������5mol NaOH |
| A�� | �е�HBr��HCl����ͬ��Ԫ���⻯��е�HCl��HF | |
| B�� | Fe3O4�ɱ�ʾΪFeO•Fe2O3����Pb3O4�ɱ�ʾΪPbO•Pb2O3 | |
| C�� | CO2��Na2O2��Ӧֻ����Na2CO3��O2����SO2��Na2O2��ӦҲֻ����Na2SO3��O2 | |
| D�� | SiO2���γ�ԭ�Ӿ��壬һ��������CO2Ҳ���γ�ԭ�Ӿ��� |
| A�� | ����ͼ�����ȼ�պͱ�ը�й� | |
| B�� | �ޡ��顢��˿����ë���ϳ���ά��������ά������������ά�� | |
| C�� | ��ѧ���õ��������Ƴ��ˡ����׳������������˹�����������ҩ����ӵ���Դ���ͷ���ɱ����ϸ���������׳���˵����һ�������£����ӵ����˶������˹������²��ܽ��� | |
| D�� | ����ҵ�ŷŵ�CO2�����ܽ��͵��������ЧӦ���������ϳɾ�̼�����ɽ������ϣ�ʵ��̼��ѭ������ |
| A�� | ���п�����AlO2- Ҳ�п�����Al3+ | |
| B�� | ����Ϊ��ɫ��ζ���壬���һ����CO32- | |
| C�� | �����Ǿ��д̼�����ζ�����壬��ס��Ҿ�����ͬ�ĵ����� | |
| D�� | ���ס��Ҿ�Ϊ���ӣ��ס�������������ͬһ��Һ��һ�����ܴ������� |
| A�� | ��Һʱ��ˮ��Һһ�����¿ڷų� | |
| B�� | ����ʱ������¶ȼ�ˮ�����¶˸���������ƿ֧�ܿ����أ��ռ�������ַе�ƫ�� | |
| C�� | �ζ�ʱ�����ֿ��Ƶζ��ܻ����������ճ���ƿ���ߵα����۾�ע�ӵζ����е�Һ�� | |
| D�� | ��ȡ20.0mLŨ����ʱ�����Ӷ�������ȡҺ�����ƫ�� |