题目内容
3.将2.8gFe粉加入到含CuSO4 10g的90mL的溶液中,Fe粉完全反应.再向反应后的溶液中加水,使溶液的体积为100mL,请计算:(1)生成FeSO4的质量是多少?
(2)反应后的溶液或中SO${\;}_{4}^{2-}$的物质的量浓度是多少?
(3)反应后的溶液中Cu2+的物质的量浓度是多少?
分析 (1)反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,先进行过量计算,根据不足量物质计算,据此解答;
(2)根据反应中硫酸根离子的物质的量守恒计算;
(3)根据参加反应的铁的量求反应消耗的硫酸铜的物质的量,再求出剩余的硫酸铜,即可求出铜离子的物质的量和浓度.
解答 解:(1)设10g硫酸铜完全反应需要Fe的质量为m,则:
Fe+CuSO4=FeSO4+Cu
56 160
m 10g
所以m=3.5g>2.8g,故Fe不足,Fe完全反应,
根据Fe元素守恒:m(FeSO4)=$\frac{2.8g×152}{56}$=7.6g;
答:生成FeSO4的质量为7.6g;
(2)反应中硫酸根离子的物质的量不变,则n(SO42-)=n(CuSO4)=$\frac{10g}{160g/mol}$=0.0625mol,
所以c(SO42-)=$\frac{0.0625mol}{0.1L}$=0.625mol/L;
答:反应后的溶液中SO42-的物质的量浓度是0.625mol/L;
(3)Fe完全反应后,生成Cu的物质的量nmol,则:
Fe+CuSO4=FeSO4+Cu
56 1mol
2.8g nmol
解得n=0.05mol,则溶液中剩余的Cu2+的物质的量浓度是$\frac{0.0625mol-0.05mol}{0.1L}$=0.125mol/L;
答:溶液中剩余的Cu2+的物质的量浓度是0.125mol/L.
点评 本题考查根据化学方程式的计算,比较基础,旨在考查学生对基础知识的理解掌握,注意过量计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列化学用语不正确的是( )
| A. | 铀(U)的两种核素:${\;}_{92}^{235}$U和${\;}_{92}^{238}$U | |
| B. | CO2的结构式:O=C=O | |
| C. | 乙醇分子的比例模型: | |
| D. | Cl-结构示意图: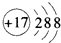 |
14.常温下,下列各组物质因存在氧化还原反应而不能共存的是( )
| A. | H+,C6H5O-,CH3COO-,MnO4- | B. | 葡萄糖,Cu2+,Na+,OH- | ||
| C. | Fe3+,NO3-,SO42-,H+ | D. | OH-,Al3+,NH4+,AlO2- |
11.下列物成中,互为同分异构体的是( )
| A. | 淀粉和纤维素 | B. | 淀粉和葡萄糖 | C. | 蔗糖和麦芽糖 | D. | 果糖和蔗糖 |
18.烃类分子中的碳原子与其它原子的结合方式是( )
| A. | 形成四对共用电子对 | B. | 通过非极性键 | ||
| C. | 通过两个共价键 | D. | 通过离子键和共价键 |
8.如图立方烷(C8H8)的球棍模型,下列有关说法不正确的是( )
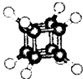

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
15.将等物质的量的X、Y气体充入固定容积的密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件建立新的平衡时,下表中关于新平衡与原平衡的比较正确的是 ( )
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
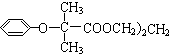
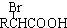 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$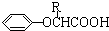
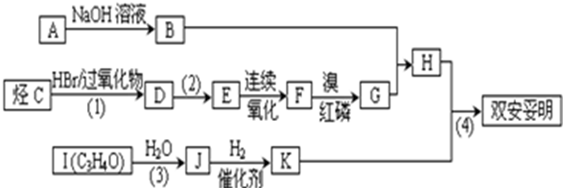
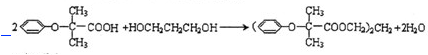
 .
.